Chemické reakcie Charakteristiky, časti, typy, príklady

- 2381
- 126
- Valentín Dula
Ten chemické reakcie Sú to zmeny, ktoré záleží na usporiadaní svojich atómov, a konajú sa, keď sa do styku dostanú dve rôzne látky alebo zlúčeniny. V procesných zmenách, ktoré je možné okamžite vnímať; ako je zvýšenie teploty, chladenia, tvorby plynu, zábleskov alebo zrážok tuhej látky.
Najbežnejšie chemické reakcie často zostanú bez povšimnutia v každodennom živote; Tisíce z nich sa vykonávajú v našich telách. Iní sú však viditeľnejšie, pretože ich môžeme vykonať v kuchyni výberom správneho náradia a ingrediencií; Napríklad premiešajte hydrogenuhličitan s octom, tavkový cukor vo vode alebo okyslil šťavu z Coloradu.
 Reakcia bikarbonátu a octu je príkladom opakujúcej sa chemickej reakcie v kuchyni. Zdroj: Kate Ter Har (https: // www.Flickr.com/photos/katerha/5703151566)
Reakcia bikarbonátu a octu je príkladom opakujúcej sa chemickej reakcie v kuchyni. Zdroj: Kate Ter Har (https: // www.Flickr.com/photos/katerha/5703151566) V laboratóriách sa chemické reakcie stávajú obvyklejšími a bežnejšími; Všetky sa vyskytujú vo vnútri kadičky (kadičky) alebo fľaše Erlenmeyer. Ak zdieľajú spoločné, žiadny nie je jednoduchý, pretože skrývajú zrážky, prerušenie odkazov, mechanizmy, formovanie spojení, energetické a kinetické aspekty.
Existujú chemické reakcie také pozoruhodné, že fanúšikovia a vedci, ktorí poznajú toxikológiu činidiel a niektoré bezpečnostné opatrenia, ich reprodukujú vo veľkých mierkach vo fascinujúcich demonštračných aktoch.
[TOC]
Koncept chemickej reakcie
Chemické reakcie sa uskutočňujú, keď dôjde k prerušeniu spojenia (iónového alebo kovalentného), takže sa vytvorí iná na mieste; Dva atómy alebo ich súbor z nich prestanú silne interagovať, aby spôsobili nové molekuly. Vďaka tomu je možné určiť chemické vlastnosti zlúčeniny, jej reaktivita, stabilita, s tým, čo reaguje.
Okrem toho, že sú zodpovední za chemické reakcie, ktoré sa záležitosť neustále transformuje, bez ich atómov vysvetľuje vznik zlúčenín, ako sú ich poznáme.
Aby sa odkazy na porušili, je potrebná energia a keď sa vytvoria odkazy, uvoľní sa. Ak je absorbovaná energia vyššia ako energia, hovorí sa, že reakcia je endotermálna; Máme okolité chladenie. Aj keď je uvoľňovanie tepla lepšie ako absorbovanie, bude to exotermická reakcia; Okolie je zahrievané.
Charakteristiky chemických reakcií
Kinetika
Molekuly teórie musia navzájom spolupracovať, pričom so sebou nie je dostatok kinetickej energie, aby uprednostňovali rozbitie spojenia. Ak sú vaše zrážky pomalé alebo neefektívne, chemická reakcia je kineticky ovplyvnená. Môže sa to stať buď fyzikálnymi stavmi látok, alebo ich geometriou alebo štruktúrou.
V reakcii sa teda záležitosť transformuje absorbovaním alebo uvoľňovaním tepla, zatiaľ čo utrpenie kolízií, ktoré uprednostňujú tvorbu výrobkov; Najdôležitejšie zložky akejkoľvek chemickej reakcie.
Ochrana hmotnosti
Z dôvodu zákona o zachovaní hromadnej ochrany zostáva celková hmotnosť súboru konštantná po chemickej reakcii. Súčet jednotlivých hmotností každej látky sa teda rovná hmotnosti získanej výsledkom.
Fyzické zmeny a/alebo zmeny stavu
Výskyt chemickej reakcie môže byť sprevádzaný zmenou stavu komponentov; to znamená variácia v pevnom, kvapalnom alebo plynnom stave materiálu.
Nie všetky zmeny v stave však naznačujú chemickú reakciu. Napríklad: Ak sa voda v dôsledku tepla odparuje, vodná para produkovaná po tejto zmene stavu zostáva vodou.
Farebná zmena
Medzi fyzikálne atribúty, ktoré sú výsledkom chemickej reakcie, vyniká zmena farby reagencií oproti farbe konečného produktu.
Tento jav je výrazný pri pozorovaní chemickej reakcie kovov s kyslíkom: keď je oxidovaný kov, mení svoju charakteristickú farbu (zlato alebo striebro, ako je to tak), aby sa stal oranžovo-redishovým tónom, známym ako hrdza.
Prepustenie plynu
Táto charakteristika sa prejavuje ako bublajúci alebo s emisiou konkrétnych zápachov.
Všeobecne sa bubliny objavujú v dôsledku predloženia kvapaliny pri vysokých teplotách, čo podporuje zvýšenie kinetickej energie molekúl, ktoré sú súčasťou reakcie.
Zmeny teploty
V prípade, že teplo je katalyzátorom chemickej reakcie, v konečnom produkte sa vyvoláva zmena teploty. Preto vstup a výstup tepla v procese môžu byť tiež charakteristikou chemických reakcií.
Časti chemickej reakcie
Reagencie a výrobky
Akákoľvek chemická reakcia predstavuje rovnicu typu:
A + B → C + D
Kde A a B sú reaktanty, zatiaľ čo C a D výrobky. Rovnica nám hovorí, že atóm alebo molekula A reaguje s B, aby spôsobil produkty C a D. Toto je nezvratná reakcia, pretože reaktanty nemôžu pochádzať z produktov. Namiesto toho je reakcia uvedená nižšie reverzibilná:
A + B C + D
Je dôležité zdôrazniť, že hmotnosť reaktantov (a+b) sa musí rovnať hmotnosti produktov (c+d). Inak by sa cesto nezachovalo. Podobne musí byť počet atómov pre daný prvok rovnaký pred a po šípke.
Nad šípkou označuje niektoré špecifikácie reakcie: teplota (A), výskyt ultrafialového žiarenia (HV) alebo použitý katalyzátor.
Môže vám slúžiť: sklo hodínReakčné prostriedky
Pokiaľ ide o život a reakcie, ktoré sa vyskytujú v našich telách, médium reakcie je vodné (AC). Chemické reakcie sa však môžu vyvíjať v akomkoľvek kvapalnom médiu (etanol, ľadovec kyselina octová, toluén, tetrahydrofurán atď.) pokiaľ sú reagencie dobre rozpustené.
Nádoby alebo reaktory
Kontrolované chemické reakcie sa vyskytujú v nádobe, či už ide o jednoduchý sklenený materiál alebo v reaktore z nehrdzavejúcej ocele.
Typy chemických reakcií
Typy chemických reakcií sú založené na tom, čo sa deje na molekulárnej úrovni; Aké odkazy sa zlomia a ako sa atómy nakoniec pripoja. Zohľadňuje sa tiež, či druhy získavajú alebo strácajú elektróny; Aj keď sa to vyskytuje vo väčšine chemických reakcií.
Tu sú rôzne typy chemických reakcií, ktoré existujú.
- Oxidačná redukcia (Rédox)
Oxidácia medi
V príklade patiny dochádza k oxidačnej reakcii: kovová meď stráca elektróny v prítomnosti kyslíka, aby sa transformovala do zodpovedajúceho oxidu.
4CU (s) + o2(g) => cu2Ty)
Oxid meďnatého (I) pokračuje v oxidácii, aby sa získal oxid meďnatého (II):
2cU2Alebo (s) + alebo2 => 4CUO (s)
Tento typ chemickej reakcie, kde druhy zvyšujú alebo znižujú svoje oxidačné číslo (alebo stav), je známy ako oxidácia a redukčná reakcia (Rédox).
Kovová meď s oxidačným stavom 0, najskôr stráca elektrón a potom druhá (oxidizuje), zatiaľ čo kyslík zostáva (je znížená):
Cu => cu+ + a-
Cu+ => Cu2+ + a-
Ani2 + 2e- => 22-
Zisk alebo strata elektrónov sa dá určiť výpočtom oxidačných čísel pre atómy v chemických vzorcoch ich výsledných zlúčenín.
Pre Cu2Alebo je známe, že pretože ide o oxid, má anión alebo2-, Aby sa udržalo neutralizované zaťaženie, každá z dvoch atómov meďnatého musí mať +1 zaťaženie. Veľmi podobné sa vyskytuje u Cuo.
Meď, keď oxidovaná získava pozitívne oxidačné čísla; a kyslík, ktorý sa má znížiť, záporné oxidačné čísla.
Železo a kobalt
Ďalšie príklady pre reakcie sú uvedené nižšie. Podobne sa urobí stručný komentár a bude uvedené zmeny v oxidačných číslach.
Fecl2 + Kokl3 => Fecl3 + Kokl2
Ak sa vypočítajú oxidačné čísla, bude potrebné poznamenať, že čísla CL zostávajú s konštantnou hodnotou -1; Nie tak, s tými vierami a co.
Na prvý pohľad sa železo oxidovalo, zatiaľ čo kobalt sa znížil. Ako to? Pretože železo interaguje teraz s dvoma cl- Ale s tromi, je to najviac elektronegatívny atóm chlóru ako železo a kobalt. Na druhej strane, opak sa stane s kobaltom: prechádza z interakcie s tromi CL- na dve z nich.
Ak predchádzajúce zdôvodnenie nie je jasné, sú napísané chemické rovnice čistého prenosu elektrónov:
Vernosť2+ => Viera3+ + a-
Co3+ + a- => Co2+
Preto viera2+ Oxiduje, zatiaľ čo CO3+ je redukovaný.
Jód a mangán
6 kmno4 + 5 ki + 18HCl => 6mncl2 + 5 kio3 + 6KCl+ 9H2Ani
Chemikália vyššie sa môže zdať komplikovaná, ale nie je to. Chlór (CL-) nie kyslík (alebo2-) Skúsenosti so ziskom alebo stratou ich elektrónov. Jód a mangán, áno.
Berúc do úvahy iba zlúčeniny s jódom a mangánom, ktoré máte:
Ki => kio3 (Oxidačné číslo: -1 až +5, stráca šesť elektrónov)
Kmno4 => Mcl2 (Oxidačné číslo: +7 až +2, vyhrá päť elektrónov)
Jód oxiduje, zatiaľ čo mangán sa zníži. Ako to vedieť bez výpočtu? Pretože jód prechádza z bytia s draslíkom na interakciu s tromi kyslíkom (viac elektronegatívnych); A mangán medzitým stráca interakcie s kyslíkom, aby bol s chlórom (menej elektronegatívnym).
KI nemôže stratiť šesť elektrónov, ak KMNO4 Vyhrajte päť; Preto musí byť počet elektrónov v rovnici vyvážený:
5 (ki => kio3 + 6e-)
6 (kmno4 + 5e- => Mcl2)
Čo vedie k čistému prenosu 30 elektrónov.
Spaľovanie
Spaľovanie je energická a energetická oxidácia, pri ktorej sa uvoľňuje svetlo a teplo. Všeobecne sa v tomto type chemickej reakcie kyslík zúčastňuje ako oxidačné alebo kombinované činidlo; Zatiaľ čo redukčný činidlo je palivo, ktoré spaľuje na konci účtu.
Kde je popol, došlo k spaľovaniu. Sú zložené z uhlia a oxidov kovov; Aj keď jeho zloženie logicky závisí od toho, čo bolo palivo. Nižšie sú uvedené niekoľko príkladov:
C (s) + o2(g) => co2g)
2co (g) + alebo2(g) => 2 co2g)
C3H8g) + 5o2(g) => 3co2g) + 4h2O (g)
Každá z týchto rovníc zodpovedá úplnému spaľovaniu; to znamená, že všetko palivo reaguje s nadbytkom kyslíka, aby sa zaručila jeho úplná transformácia.
Malo by sa tiež poznamenať, že CO2 a h2Alebo sú to plynné väčšinové výrobky, keď horia sýtené telá (ako je drevo, uhľovodíky a živočíšne tkanivá). Je nevyhnutné, aby sa vytvorilo niektoré uhlie alotropné, kvôli kyslíkovej nedostatočnosti, ako aj menej okysličeným plynom, ako sú CO a nie.
- Syntéza
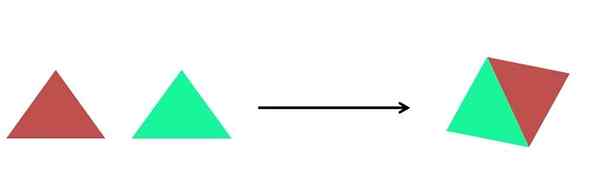
 Grafické znázornenie syntéznej reakcie. Zdroj: Gabriel Bolívar.
Grafické znázornenie syntéznej reakcie. Zdroj: Gabriel Bolívar. Na vynikajúcom obrázku je zobrazené veľmi jednoduché znázornenie. Každý trojuholník je zlúčenina alebo atóm, ktorý sa spája a vytvára jednu zlúčeninu; Dva trojuholníky tvoria rovnobežník. Masy sa zvyšujú a fyzikálne a chemické vlastnosti produktu sa často veľmi líšia od vlastností svojich činidiel.
Môže vám slúžiť: EnthalpiaNapríklad spaľovanie vodíka (čo je tiež reagujúca na redox), produkuje oxid vodíka alebo hydrid kyslíka; Známejšie ako Agua:
H2g) + alebo2(g) => 2h2O (g)
Zmiešaním oboch plynov pri vysokej teplote, popáleniny produkujúce plynnú vodu. Ochladené teploty, výpary kondenzujú, aby sa poskytla kvapalná voda. Niekoľko autorov považuje túto syntetickú reakciu za jednu z možných alternatív, ktorá nahradí fosílne palivá pri získavaní energie.
H-H a O = o Odkazy sú rozdelené tak, aby vytvorili dva nové jednoduché odkazy: H-O-H. Voda, ako je dobre známe, je jedinečná látka (za romantickým zmyslom) a jej vlastnosti sa veľmi líšia od plynného vodíka a kyslíka.
Iónové zlúčeniny
Tvorba iónových zlúčenín z jeho prvkov je tiež príkladom syntéznej reakcie. Jedným z najjednoduchších je tvorba kovových halgenuros skupín 1 a 2. Napríklad syntéza bromidu vápenatého:
CA (s) + br2(L) => CABR2(S)
Všeobecnou rovnicou pre tento typ syntézy je:
M (s) + x2 => Mx2(S)
Koordinácia
Keď vytvorená zlúčenina zahŕňa kovový atóm v elektronickej geometrii, hovorí sa, že ide o komplex. V komplexoch zostávajú kovy spojené s ligandom slabými kovalentnými väzbami a tvoria sa koordinačnými reakciami.
Napríklad máte komplex [Cr (NH3)6]3+. Toto sa tvorí, keď je CR katión3+ je v prítomnosti molekúl amoniaku, NH3, ktoré pôsobia ako chrómové ligandy:
Cr3+ + 63 => [Cr (NH3)6]3+
Nižšie je uvedená výsledná koordinácia oktadron okolo chrómového kovového centra:
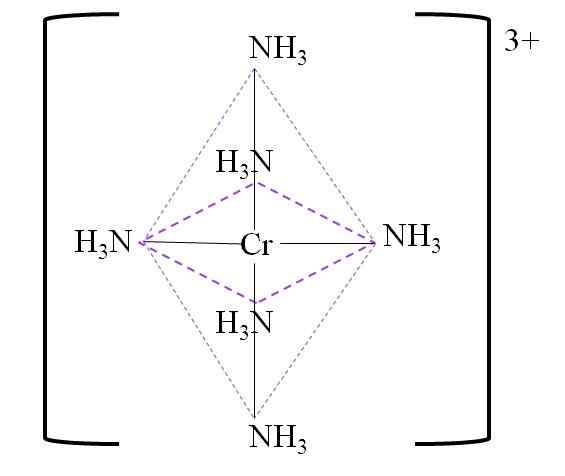 Koordinácia oktadron pre komplex. Zdroj: Gabriel Bolívar.
Koordinácia oktadron pre komplex. Zdroj: Gabriel Bolívar. Všimnite si, že zaťaženie chrómom 3+ nie je v komplexe neutralizované. Jeho farba je fialová, a preto je oktadron zastúpený uvedenou farbou.
Niektoré komplexy sú zaujímavejšie, ako v prípade určitých enzýmov, ktoré koordinujú atómy železa, zinku a vápnika.
- Rozklad
Rozklad sa stáva opakom syntézy: zlúčenina sa rozbije na jeden, dva alebo tri prvky alebo zlúčeniny.
Napríklad existujú nasledujúce tri rozklady:
2HGO (s) => 2hg (l) + o2g)
2h2Ani2(L) => 2h2Alebo (l) + o2g)
H2Co3(ac) => co2g) + h2Alebo (l)
HGO je červenkastá pevná látka, ktorá sa rozpadá na kovovú ortuť, čiernu tekutinu a kyslík.
Peroxid vodíka vodíka trpí rozkladom, dodáva kvapalnú vodu a kyslík.
A kyselina uhličitá, medzitým sa rozkladá v oxidu uhličitého a kvapalnej vody.
„Suchejší“ rozklad je ten, ktorý utrpeli kovové uhličitany:
Zlodej3(s) => Cao (s) + co2g)
Sopka triedy
 Sopka dichromátu nábytku. Zdroj: наталия [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Sopka dichromátu nábytku. Zdroj: наталия [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Rozkladová reakcia, ktorá sa používa v triedach chémie4)2Cr2Ani7. Táto oranžová karcanogénna soľ (preto by sa mala zaobchádzať s veľkou starostlivosťou), popáli sa, aby uvoľnila veľa tepla a vytvorila zelenú pevnú látku, chromický oxid, cr2Ani3:
(NH4)2Cr2Ani7(s) => cr2Ani3(s) + 4h2Alebo (g) + n2g)
- Posunutie
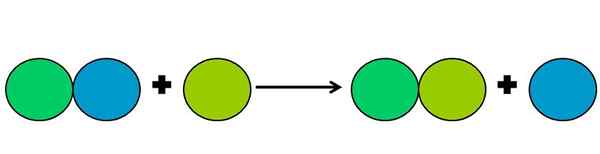 Grafické znázornenie reakcie na posun. Zdroj: Gabriel Bolívar.
Grafické znázornenie reakcie na posun. Zdroj: Gabriel Bolívar. Reakcie na posunutie sú typom reakčného redoxu, v ktorom jeden prvok vytlačí druhý v zlúčenine. Posunutý prvok končí znížením alebo získaním elektrónov.
Na zjednodušenie vyššie uvedeného je zobrazený horný obrázok. Kruhy predstavujú prvok. Zistilo sa, že zelený kruh Limy vytesňuje modrý a je zvonka; Ale nielen to, ale modrý kruh je v tomto procese znížený a je oxidovaný zelenou lima.
Vodík
Napríklad nasledujúce chemické rovnice na odhalenie vyššie uvedeného:
2AL (s) + 6HCl (ac) => alcl3(Ac) + 3h2g)
Zr (s) + 2h2Alebo (g) => zro2(s) + 2h2g)
Zn (s) + h2SW4(ac) => znso4(Ac) + h2g)
Aký je posunutý prvok pre tieto tri chemické reakcie? Vodík, ktorý sa redukuje na molekulárny vodík, h2; prechádza z oxidačného čísla +1 na 0. Všimnite si, že hliník, zirkónia a zinkové kovy môžu natlačiť hydrogény kyselín a vody; Zatiaľ čo meď, striebro alebo zlato, nemôže.
Kovy a halogén
Podobne sú k dispozícii tieto dve ďalšie reakcie na vytesnenie:
Zn (s) + cuo4(ac) => cu (s) + Znso4(Ac)
Cl2(G) + 2NAI (ac) => 2Nacl (ac) + i2(S)
V prvej reakcii zinok vytlačí menej aktívnu kovovú meď; Oxidizuje zinok, zatiaľ čo meď sa zníži.
V druhej reakcii, na druhej strane, chlór, reaktívnejší prvok ako jód, vytlačí ho v sodíkovej soli. Tu sa vyskytuje dozadu: najreaktívnejší prvok je redukovaný oxidáciou posunutého prvku; Preto je chlór znížený oxidáciou na jód.
- Tvorba plynu
Pri reakciách bolo zrejmé, že niekoľko z nich generovalo plyny, a preto vstupujú aj do tohto typu chemickej reakcie. Podobne sa reakcie predchádzajúcej časti, vytesnenie vodíka aktívnym kovom, považujú reakcie tvorby plynu.
Môže vám slúžiť: Dodecil sulfát sodný (SDS): Štruktúra, vlastnosti, použitiaOkrem tých, ktoré už boli spomenuté, napríklad kovové sulfidy uvoľňujte sulfid vodíka (ktorý vonia zhnitými vajciami), keď sa pridá kyselina chlorovodíková:
Nat2S (s) + 2HCl (ac) => 2Nacl (ac) + h2S (g)
- Metahéza alebo dvojité vytesnenie
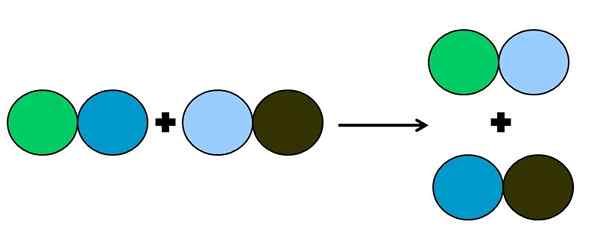 Grafické znázornenie reakcie s dvojitým posunutím. Zdroj: Gabriel Bolívar.
Grafické znázornenie reakcie s dvojitým posunutím. Zdroj: Gabriel Bolívar. Pri reakcii metatézy alebo dvojitého posunu je to, čo sa stane zmenou párov bez prenosu elektrónov; to znamená, že sa nepovažuje za reakciu Rédox. Ako je vidieť na vynikajúcom obrázku, zelený kruh sa zlomí s tmavo modrou farbou, aby sa spojil s svetlo modrým kruhom.
Zrážky
Ak sú interakcie jedného z párov dostatočne silné na prekonanie účinku riešenia tekutín, získa sa zrazenina. Nasledujúce chemické rovnice predstavujú zrážkové reakcie:
Agno3(ac) + NaCl (ac) => agcl (s) + nano3(Ac)
Kacl2(Ac) + na2Co3(ac) => Caco3(S) + 2NACL (AC)
V prvej reakcii Cl- Vytlačí NO3- Na vytvorenie chloridu striebra, AGCL, čo je biela zrazenina. A v druhej reakcii CO32- vytesňuje CL- Na zrážanie uhličitanu vápenatého.
Bázová kyselina
Asi najúžasnejším reakciám metatanéz je reakcia neutralizačnej bázy kyseliny. Nakoniec sú ako príklady uvedené dve reakcie na bázové kyseliny:
HCl (ac) + NaOH (ac) => NaCl (ac) + h2Alebo (l)
2HCl (AC) + BA (OH)2(Ac) => bacl2(Ac) + 2h2Alebo (l)
Oh- Presúvajú sa k CL- Na vytvorenie solí vody a chloridu.
Príklady chemických reakcií
Nižšie a potom sa zmieni o niektorých chemických reakciách s ich príslušnými rovnicami a pripomienkami.
Posunutie
Zn (s) + agno3(ac) → 2AG (s) + Zn (č3)2(Ac)
Zinok vytlačí striebro v dusičnanovej soli: znižuje Ag+ Ag. V dôsledku. Na druhej strane, dusičnan je kombinovaný s iónmi Zn2+ Výsledkom dusičnanu zinku.
Neutralizácia
Zlodej3(S) + 2HCl (AC) → CACL2(Ac) + h2Alebo (l) + co2g)
Kyselina chlorovodíková neutralizuje uhličitanovú soľ vápnik, aby sa vyrábala soľ, chlorid vápenatý, voda a oxid uhličitý. CO2 bubliny a sú detekované vo vode. Tento bubb3.
NH3(G) + HCl (G) → NH4Cl (s)
V tejto druhej reakcii HCL výpary neutralizujú plynný amoniak. Chlorid soľného amónneho, NH4Cl, je tvorený ako belavý dym (dolný obrázok), pretože obsahuje veľmi jemné častice zavesené vo vzduchu.
 Tréningová reakcia amónneho chloridu. Zdroj: Adam Rędikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Tréningová reakcia amónneho chloridu. Zdroj: Adam Rędikowski [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Dvojitý posun
Agno3(AC) + NACL (AC) → AGCL (S) + Nano3(Ac)
Pri reakcii na dvojité posunutie dochádza k výmene „párov“. Striebro zmení pár sodným. Výsledkom je, že nová soľ, strieborná chlorid, AGCL, sa vyzráža ako mliečna pevná látka.
Reduktor
 V chemickej reakcii sa uvoľňuje teplo psa, zvuk a modré svetlo. Zdroj: Maxim Bilovitskiy Via Wikipedia.
V chemickej reakcii sa uvoľňuje teplo psa, zvuk a modré svetlo. Zdroj: Maxim Bilovitskiy Via Wikipedia. Existuje nespočetné množstvo reakcií Rédox. Jedným z najpôsobivejších je Barkin Dog:
8 n2Alebo (g) + 4 cs2(L) → S8(S) + 4 CO2g) + 8 n2g)
Uvoľnená energia je natoľko, keď sa vytvoria tri stabilné výrobky, že modrý blesk (vynikajúci obraz) a výrazné zvýšenie tlaku spôsobeného plynmi (CO (CO2 a n2).
A okrem toho je to všetko sprevádzané veľmi silným zvukom podobným štekaniu psa. Vyrobená síra, s8, Zlato prikryte vnútorné steny trubice.
Ktorý druh je redukovaný a ktorý je oxidovaný? Spravidla majú prvky oxidačné číslo 0. Preto musí byť síra a dusík vo výrobkoch druhmi, ktoré získali alebo stratili elektróny.
Oxidovaná síra (stratené elektróny), pretože v CS mala oxidačné číslo -22 (C4+Siež22-):
Siež2- → S0 + 2e-
Zatiaľ čo dusík sa znížil (vyhral elektróny), pretože mal oxidačné číslo +1 v N2Alebo (n2+Ani2-):
2n+ + 2e → n0
Vyriešené chemické reakcie
- Cvičenie 1
Čo soľ sa vyzráža v ďalšej reakcii vo vodnom médiu?
Nat2S (ac) + feso4(Ac) →?
Spravidla, všetky sulfidy, s výnimkou vytvorených s alkalickými kovmi a amónnymi, zráža vo vodnom médiu. Vyskytuje sa na dvojité posunutie: železo sa viaže na sulfid a sodík s sulfátom:
Nat2S (ac) + feso4(ac) → fes (s) + na2SW4(Ac)
- Cvičenie 2
Aké výrobky získame z nasledujúcej reakcie?
Pečiatka3)2 + CA (OH)2 →?
Hydroxid vápenatý nie je vo vode príliš rozpustný; Ale pridanie dusičnanu medi ho pomáha solubilizovať, pretože reaguje na vytvorenie zodpovedajúceho hydroxidu:
Pečiatka3)2(AC) + CA (OH)2(AC) → Cu (OH)2(s) + ca (nie3)2(Ac)
Cu (OH)2 Okamžite sa rozpoznáva za to, že je modrá zrazenina.
- Cvičenie 3
Aká soľ sa vyskytne pri ďalšej neutralizačnej reakcii?
Al (oh)3(s) + 3HCl (ac) → ¿¿?
Hliníkový hydroxid sa správa ako báza reagujúca s kyselinou chlorovodíkovou. Pri reakcii neutralizácie kyseliny (z Brnsted-Lowry) sa vždy vytvára voda, takže druhým produktom musí byť chlorid hliníka, ALCL3:
Al (oh)3(S) + 3HCl (AC) → Alll3(Ac) + 3h2Ani
Tentokrát ALCL3 Nezráža sa, pretože je to soľ (do istej miery) rozpustná vo vode.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Ana Zita. (18. novembra 2019). Chemické reakcie. Získané z: Todamateria.com
- Kashyap vyas. (23. januára 2018). 19 Cool Chemical Reakcie, ktoré provední vedia, jemne. Získané z: Zaujímavé invalidovanie.com
- Prekrásna chémia.sieť.F.). Reakcia. Získané z: Krásnachémia.slepo
- Wikipedia. (2019). Chemická reakcia. Zdroj: In.Wikipedia.orgán

