Exotermické a endotermické reakcie
- 724
- 198
- MUDr. Žigmund Boška
 Spaľovanie je príkladom exotermickej reakcie, pretože uvoľňuje teplo. Pokiaľ ide o svoju časť, ľad sa topí endotermickou reakciou, pretože vyžaduje tepelnú energiu
Spaľovanie je príkladom exotermickej reakcie, pretože uvoľňuje teplo. Pokiaľ ide o svoju časť, ľad sa topí endotermickou reakciou, pretože vyžaduje tepelnú energiu Ten exotermické a endotermické reakcie Líšia sa v skutočnosti, že tepelná energia prvej uvoľňovania, zatiaľ čo ju absorbuje, podľa tepelných zmien, ktoré sa vyskytujú počas chemických reakcií.
Podobne sa do chemických reakcií môžu podieľať iné typy energie, pretože niekedy počas reakcie sa vyrábajú svetlá energia, zvuková energia a dokonca aj elektrina.
Zohľadniť nielen teplo, ale aj iné typy energie, chemické reakcie sú klasifikované ako exergonický a Endermanika. Exergonická reakcia uvoľňuje pri výrobe energiu, zatiaľ čo ju endegonic absorbuje.
V tomto prípade je exotermická reakcia tiež exergonická reakcia, pretože uvoľňuje teplo. Jedným z najznámejších príkladov je spaľovanie. Zakaždým, keď sa spáli kúsok dreva, uvoľní sa kalorická a jasná energia.
Na druhej strane, jedna z najznámejších endergných chemických reakcií sa vyskytuje pri topení kocky ľadu, pretože ľad absorbuje tepelnú energiu životného prostredia na transformáciu na kvapalnú vodu.
Exotermická reakcia sa môže vyskytnúť spontánne, aj keď niekedy musíte urobiť nejakú prácu, aby ste mohli začať. Avšak, aby sa vyskytla endotermická reakcia, je vždy potrebné, aby prostredie vykonávali prácu v systéme.
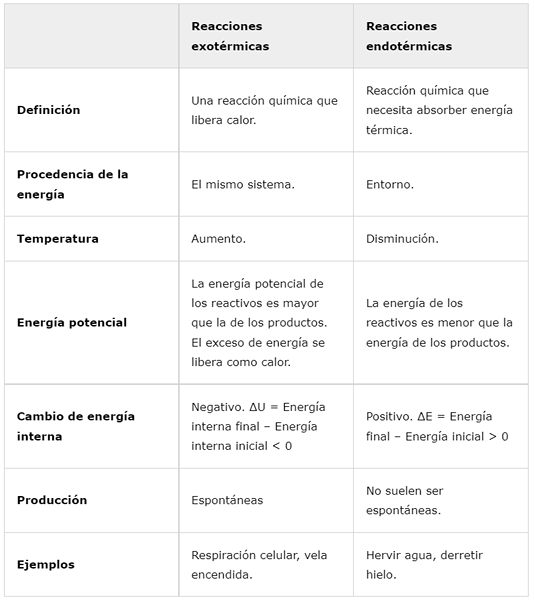
Exotermické reakcie | Endotermické reakcie | |
Definícia | Chemická reakcia, ktorá uvoľňuje teplo. | Chemická reakcia, ktorá potrebuje absorbovať tepelnú energiu. |
Pôvod energie | Rovnaký systém. | Okolo. |
Teplota | Zvýšiť. | Pokles. |
Potenciálna energia | Potenciálna energia reagencií je väčšia ako energia výrobkov. Prebytočná energia sa uvoľňuje ako teplo. | Energia reagencií je menšia ako energia výrobkov. |
Vnútorná zmena energie | Negatívny. ΔU = konečná vnútorná energia - počiatočná vnútorná energia < 0 | Pozitívny. ΔE = konečná energia - počiatočná energia> 0 |
Výroba | Spontánna | Zvyčajne nie sú spontánne. |
Príklady | Bunkové dýchanie, horiace sviečky. | Varte vodu, roztopte ľad. |
Exotermické reakcie
Definícia
Typ chemickej reakcie, ktorá uvoľňuje teplo, keď sa vykonáva.
Môže vám slúžiť: cyklohexen: štruktúra, vlastnosti, syntéza a použitiaPôvod energie
Rovnaký systém poskytuje energiu tak, aby došlo k reakcii.
Teplota
Po reakcii je a zvýšiť teplota.
Potenciálna energia
Ak dôjde k chemickej reakcii medzi činidlami, sú medzi nimi a ostatné prerušené odkazy, aby sa vytvorili nové molekuly. Ale nie všetky odkazy spájajú atómy a molekuly s rovnakou silou, preto je energia na prelomenie alebo vytvorenie každého spojenia iná.
Počas každej reakcie sa zlomia a vytvárajú rôzne počty odkazov, takže energia je iná. Pri exotermickej reakcii potenciálna energia reagencií je starší ako výrobky, a keďže sa energia zachováva, prebytok sa uvoľňuje ako teplo.
Vnútorná zmena energie
Vnútorná energia súvisí so schopnosťou systému vykonávať prácu a zahŕňa jeho potenciálnu energiu a kinetickú energiu. Absolútna energia systému nie je určená, ale jeho variácia, nazývaná ΔU.
Podľa toho, čo bolo povedané v predchádzajúcej časti, je zmena vnútornej energie ΔU negatívna.
ΔU = konečná vnútorná energia - počiatočná vnútorná energia < 0
Výroba
Väčšina exotermických reakcií je spontánna, to znamená, že sa konajú pre seba, bez potreby pridávať vonkajšiu energiu, kým sa reagencie nevyčerpajú.
Príklady
Oxidačné reakcie a tie, ktoré vedú k tvorbe zlúčeniny, sú zvyčajne exotermické reakcie:
1. Rozpustenie detergentu vo vode
Pri rozpúšťaní prachu odevov v malej studenej vode sa cíti teplý, keď sa dotýka.
2. Bunkové dýchanie
U zvierat a rastlín sa proces bunkového dýchania vykonáva ako súčasť uhlíkového cyklu. Dýchanie používa glukózu a kyslík na návrat oxidu uhličitého, vody a energie podľa reakcie:
Môže vám slúžiť: oxid titánu (IV): Štruktúra, vlastnosti, použitiaC6H12Ani6 + 62 → 6co2 + H2O + energia (ATP)
3. Horiaca sviečka
Horiaca sviečka okrem svetla vydáva teplo a ďalšie látky:
Kyslík kyslík → Voda + oxid uhličitý + svetlo a teplo
4. Bombardovanie chrobáka
Tento hmyz sa bráni postrekovaním aerosólu o jeho predátoroch. Chrobák udržuje tekutiny a enzýmy v samostatných priehradkách, ktoré sa nachádzajú v bruchu.
Ak je ohrozený, vylúči tekutiny smerom k enzýmu a chemickej reakcii, ktorá vytvára paru a teplo.
5. Oceľová a octová vlna
Kov ako železo sa pomaly oxiduje pri reakcii na životné prostredie, ale ak sa ocot pridá do malej oceľovej vlny, pozoruje sa, že oxidácia je oveľa rýchlejšia a zároveň generuje teplotu.
Endotermické reakcie
Definícia
Reakcie, v ktorých musia reagenty absorbovať tepelnú energiu, aby sa produkty získali.
Pôvod energie
Energia potrebná na vykonanie reakcie výnosov z životného prostredia.
Teplota
Endotermická reakcia znamená a pokles teplota.
Potenciálna energia
Na rozdiel od toho, čo sa stane s exotermickou reakciou, energia reagencií Je to menej že energia výrobkov.
Vnútorná zmena energie
Pri endotermickej reakcii je zmena vnútornej energie AE pozitívna.
ΔE = konečná energia - počiatočná energia> 0
Preto je konečná energia väčšia ako pôvodná energia.
Výroba
Endotermálne reakcie si vyžadujú, aby sa práca na systéme vykonala, takže zvyčajne nie sú spontánne.
Existujú však určité endotermické reakcie, ako je topenie ľadu a odparovanie určitých tekutín, ktoré sú spontánne pri teplote miestnosti.
Dospelo sa k záveru, že teplota prostredia je určujúcim faktorom spontánnosti chemickej reakcie.
Môže vám slúžiť: Chemické ukazovatele: pre čo sú, typy, príkladyPríklady
Mnohé z reakcií zahŕňajúcich rozpustenie soli a vo všeobecnosti rozklad látky sú zvyčajne endotermické. Rovnakým spôsobom, priechod ľadu do kvapalnej vody a parnej kvapalnej vody, tj transformácie stavu, sú tiež endotermické reakcie.
1. Fotosyntéza
Rastliny vykonávajú chemickú reakciu v prítomnosti slnečného žiarenia, v ktorom premenia oxid uhličitý a vodu na glukózu a kyslík. Chlorofyl je v tomto procese kľúčovou molekulou, ktorej chemická reakcia je:
Svetlo + 6Co2 + H2O → C6H12Ani6 + 62
Ako je vidieť, je to spätná reakcia dýchania. Na výrobu kilogramu glukózy je potrebných 15 mega joulov slnečnej energie.
2. Varte vodu a varte
Veľmi častá reakcia, ktorá vyžaduje pokračovanie energie, je vriaca voda:
H2O (kvapalina) + energia → h2O (para)
Potraviny obvykle vyžadujú vodu na varenie a rovnako ako voda, ktorú obsahujú.
3. Roztaviť ľad
Podobne je bežné, že sa ľad roztopí pri teplote miestnosti, ak je väčší ako 0 ° C:
H2O (pevná) + energia → h2O (kvapalina)
Preto sa nápoj pri pridávaní ľadu ochladzuje, pretože absorbuje energiu potrebnú na zmenu stavu z kvapaliny.
4. Studená taška
Používajú sa na ošetrenie modrín a úderov. Obsahovať vodu a obálku s chloridom amónnym. Pri poklepaní do vrecka je obálka rozbitá a reakcia chloridu amónneho s vodou, ktorá je endotermická, ochladí tašku a zmierňuje bolesť.
5. Výroba ozónu
Ultrafialové žiarenie zo slnka premieňa kyslík na ozón a uvoľňuje teplo v procese.
Tretí2 (plyn) + ultrafialové svetlo → 23 (plyn)
Odkazy
- Byju's. Rozdiel medzi edotermickými a exotermickými reakciami. Uzdravený z Byjusa.com
- Chang, R. (2013). Chémia. 11 VA. Vydanie. McGraw Hill Education.
- Grelan. Exotermické reakcie na teplé veci. Získané z: Grelane.com.
- Hein, m. (2014). Nadácie chémie vysokej školy. Mravný.
- Helmestín, a. Pochopenie endotermických a exotermických reakcií. Zotavené z: Thoughtco.com

