Exotermická reakcia
- 1208
- 42
- Alan Milota
Vysvetľujeme, aké exotermické reakcie, ich charakteristiky, rozdiely s endotermickými reakciami sú a uvádzajú niekoľko príkladov
Čo sú exotermické reakcie?
Ten exotermické reakcie Sú to chemické reakcie, ktoré uvoľňujú energiu vo forme tepla. Exotermické slovo tvorí „Exo„ čo znamená „von“ a „Termos“ čo znamená teplo, takže „exotermická reakcia“ doslova znamená, že reakcia, v ktorej teplo zhasne.
Tieto reakcie sú veľmi bežné a my ich môžeme nájsť všade, od našich domovov po bunky, ktoré sú súčasťou nášho tela.
Doma ich nájdeme v kuchyni, keď plyn horí v rohu, aby uvaril naše jedlo. Nájdeme ich tiež vo vnútri automobilových motorov, keď spaľujú palivo.
 Príklad exotermickej reakcie
Príklad exotermickej reakcie Na druhej strane, exotermické reakcie sú nevyhnutné pre život, pretože poskytujú bunkám energiu, ktorú potrebujú na život, rast a reprodukciu.
Charakteristiky exotermických reakcií
Uvoľňujú energiu vo forme tepla
Toto je hlavná charakteristika, ktorá z nich robí exotermické reakcie.
Uvoľnená energia pochádza z rovnakých reagencií
Každá chemická reakcia vyžaduje, aby sa vyskytla určitá aktivačná energia. V prípade exotermických reakcií táto energia pochádza z rovnakých činidiel, keď sa transformuje na výrobky.
Produkty exotermických reakcií sú vždy stabilnejšie ako činidlá.
Reagencie tým, že sa stávajú výrobkami, stratia časť svojej energie vo forme tepla. Z tohto dôvodu výrobky vždy zostávajú s menšou energiou ako činidla, čo ich robí stabilnejšími.
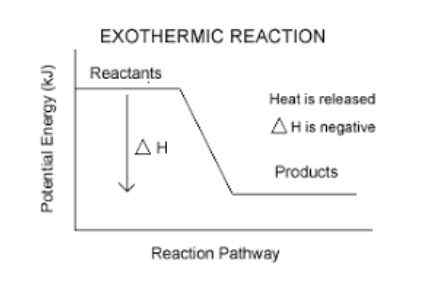
Majú negatívnu variáciu entalpie.
Je to jednoduchý spôsob, ako zistiť, či je reakcia exotermická alebo nie. Akákoľvek reakcia, ktorá má negatívny AH (čítaj delta h), bude exotermická.
- Napríklad, Spaľovacia reakcia butánu (plyn, ktorý spaľujeme v kuchyni), má entalpickú variáciu -11.823 kcal/mol. Preto je to exotermická reakcia.
Potrebujú iba spúšťač, ktorý sa vyskytne vo väčšine prípadov.
Mnoho exotermických reakcií potrebuje iba niečo, čo im dáva dostatok energie na začiatok. Potom, rovnaké teplo, ktoré uvoľňujú, stačí na udržanie reakcie chôdze.
- Napríklad, Spálením plynu je potrebná iba jedna iskra, potom plameň sa naďalej zapína, až kým plyn neskončí.
Rozdiely medzi exotermickými reakciami a endotermickými reakciami
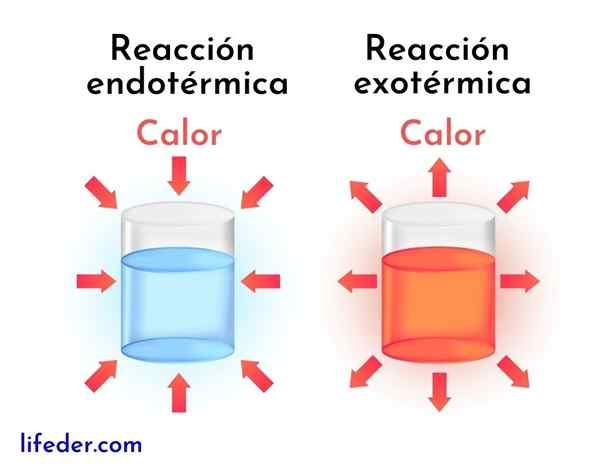
Exotermické reakcie sú opakom endotermických reakcií. V poslednom uvedenom prípade činidlá absorbujú energiu vo forme tepla namiesto toho, aby ju uvoľnili, rovnako ako v exotermických reakciách.
Ďalej sú uvedené hlavné rozdiely medzi exotermickými a endotermickými reakciami:
Exotermické reakcie | Endotermické reakcie |
Uvoľňujú energiu vo forme tepla. | Absorbujú energiu vo forme tepla. |
Majú negatívnu variáciu entalpie, to je DH<0. | Majú pozitívnu variáciu entalpie, to je dh> 0. |
Majú tendenciu zvyšovať okolitú teplotu. | Majú tendenciu znižovať teplotu alebo ochladiť okolo. |
Energia, ktorá udržuje reakciu, pochádza z rovnakých činidiel. | Energia, ktorá udržuje reakciu prechádzky, pochádza z okolia. |
Stabilnejšie výrobky sa vždy získavajú s menšou energiou. | Menej stabilné výrobky sa vždy získavajú s vyššou úrovňou energie. |
Príklady exotermických reakcií
Spaľovanie kuchynského plynu
Vo väčšine domácností na svete je plyn používaný na varenie potravín bután, ktorý má molekulárny vzorec C4H10. Tento uhľovodík sa spaľuje kyslíkom vzduchu pomocou nasledujúcej reakcie spaľovania, ktorý uvoľňuje veľké množstvo tepla:
Môže vám slúžiť: jednoduchý mikroskop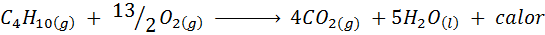
Výbuch dynamitu
Dynamit obsahuje výbušninu nazývaný nitroglycerín (c3H5N3Ani9). Táto zlúčenina rozkladá veľmi násilné uvoľňovanie veľkého množstva tepla, čo spôsobuje veľkú explóziu. Chemická reakcia je:
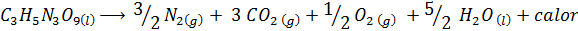
Táto reakcia má a ΔH = -368 kcal⁄mol, Je to teda exotermická reakcia.
Spontánne spaľovanie bieleho fosforu
Prvok fosforu (P) sa dá nájsť ako červený fosfor alebo biely fosfor. Biela fosfor. Reakcia je:
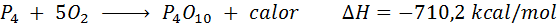
Bunkové dýchanie
Bunkové dýchanie je exotermická chemická reakcia, ktorá spočíva v oxidácii potravín, ktoré jeme. Teplo uvoľňované touto reakciou sa používajú bunkami na vykonávanie nekonečných endotermických chemických reakcií, ktoré vyžadujú energiu.
Ohňostroj
Ohňostroje obsahujú čierny strelný prach ako hlavný výbušný komponent. Gunpowder je zmes, ktorá obsahuje dusičnan draselný, grafit a uhlík síry, ktoré navzájom reagujú exotermickou reakciou. Teplo, ktoré táto reakcia uvoľňuje, vytvára širokú škálu farieb, ktoré vidíme v nebi, keď ohňostroj vybuchne.
Chemická tepelná podložka
Tepelné vankúšiky sa používajú ako horúce kompresy na zmiernenie športových zranení. Pozostávajú z utesneného vrecka obsahujúceho vodu a chemika vo vnútri malej trubice. Keď je trubica prerušená, chemik sa zmieša s vodou, ktorá produkuje exotermickú chemickú reakciu, ktorá zahrieva podložku.
Kovová reakcia sodíka s vodou
Sodík (NA) je veľmi reaktívny alkalický kov, ktorý pri príchode do kontaktu s vodou reaguje násilne a uvoľňuje veľa tepla a plynného vodíka. Reakcia je:
Môže vám slúžiť: metódy oddelenia heterogénnych zmesí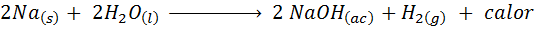
Táto reakcia uvoľňuje 1900 kalórií pre každý gram NA, ktorý reaguje s vodou. To znamená, že 1 gram sodíka by stačil na zahriatie 3 šálky strednej kávy.
Detergent
Toto je reakcia, ktorú môže ktokoľvek zažiť vo svojom dome. Pri berie hrsť prachu na umývanie odev. Je to preto, že proces rozpúšťania detergentu vo vode je exotermický.
Reakcia Trimita
Termita je zmes hliníka vo forme veľmi jemného prášku a oxidu iného kovu, ako je železo. Po iskre je reakcia, ktorá nastane,:
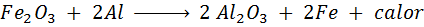
Táto reakcia uvoľňuje toľko tepla, ktoré je schopné topenia železa a používa sa veľa na zváracie vlaky Rails.
Kondenzácia vody
Pre všetky látky, zmeny plynnej fázy (kondenzácia), kvapalina na tuhú látku (tuhý) a tuhý plyn (depozícia), vždy uvoľňujte teplo, a preto sú exotermické procesy. V prípade vody kondenzácia iba 18 gramov vody uvoľňuje približne 10.000 kalórií, čo je dosť na zahriatie 15 šálok káv.
Odkazy
- Chang, R. a Goldsby, K. (2014). Chémia. 11. vydanie. New York: McGraw-Hill Education.
- Exotermická reakcia (2020, 19. decembra). Na Wikipédii. Prevzatý.Wikipedia.orgán
- Holmes, W. Siež. (1963). Teplo spaľovania fosforu a entalpie tvorby P4O10 a H3PO4. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada p. z a., F. Jo. (2014). Žabky, rakety a veľa chémie. Chemické vzdelávanie. 44-51. Doi: 10.2436/20.2003.02.134
- Termitová reakcia. University of Minnesota (Katedra chémie). Prevzaté z Chem.Hm.Edu

