Štruktúrne rádio, vlastnosti, použitia, získanie
- 3065
- 886
- Denis Škriniar
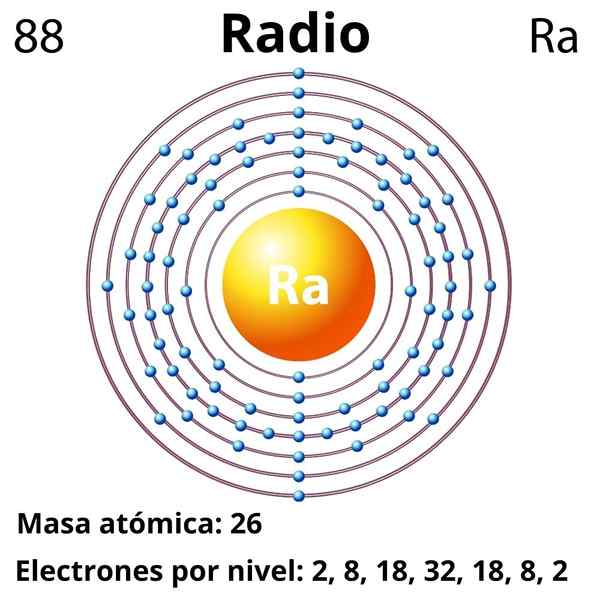
On rozhlas Je to kovový prvok patriaci do skupiny 2 periodickej tabuľky, alkalinoterrózne kovy, ktorých chemický symbol je RA. Je posledným členom tejto skupiny, ktorý sa nachádza pod bárnom a predchádza rádioaktívnym prvkom, ako je tória a urán; Polomer je však asi miliónkrát rádioaktívny, a preto nebezpečnejší ako samotný urán.
Je to prvok obklopený neuveriteľnými a nešťastnými príbehmi, všetko v dôsledku nevedomosti o jeho negatívnych účinkoch na zdravie. Bluish jas ich soli a vodných roztokov zaujatých vedcov Pierre a Marie Curie, ktorí ho objavili v roku 1898, analyzujúca nevysvetliteľné a silné žiarenie zo vzoriek rudy Pechblenda, do ktorej ich obsah uránu a uránu odstránili svoj obsah uránu a z Polónium.
 Ilustrácia Marie Curie, objavkyňa rádia
Ilustrácia Marie Curie, objavkyňa rádia Eliminovaný urán a polonium, Curie a dospel k záveru, že v Pechblende je prítomný ďalší prvok, ktorý je zodpovedný za silné žiarenie, ktoré by dômyselne mohlo kvantifikovať. Tento nový prvok bol chemicky veľmi podobný báriu; Na rozdiel od svojich spektrálnych zelených línií však mali farbu karmínu.
Po spracovaní, čistení a analýze ton Pechblendy získali 0.1 mg RACL2. Dovtedy, v roku 1902, už určili atómovú hmotu rádio, ktorého meno bolo odvodené z latinského slova „polomer“, čo znamená „lúč“. Rádio je doslova žiarivým prvkom.
O osem neskôr, v roku 1910, Marie Curie spolu s francúzskym chemikom André Louisom Debierne, podarilo sa izolovať polomer v ich kovovom tvare elektrolýzou RACL2 pomocou ortuti. Narodila sa výskumná horúčka, ktorá sa neskôr stala alarmujúcim obchodným, kultúrnym a liečivým pocitom.
[TOC]
Štruktúra
Rádio je kov, ktorého atómy sú veľmi objemné. Dôsledkom toho je, že ich kryštály sú málo hustých (hoci o niečo viac ako v Bario) a prijímajú kubickú štruktúru zameranú na telo (BCC). Z tejto štruktúry nie je hlásený žiadny iný ALOTROPE na iné teploty alebo tlaky.
Elektronická konfigurácia

Elektronická konfigurácia pre rádio je nasledovná:
[Rn] 7s2
Oxiduje s obrovským ľahkosťou, aby sa stala katiónom RA2+, ktorý je izolektronický až ušľachtilý radónový plyn. Preto všetky zlúčeniny polomeru obsahujú katión RA2+, zavedenie prevažne iónových interakcií; Odhaduje sa však, že je možné, že v dôsledku relativistických účinkov môže tvoriť spojenia s pozoruhodným kovalentným charakterom (RA-X).
Môže vám slúžiť: benzoát draselný: štruktúra, vlastnosti, získanie, použitieRádiové vlastnosti
 Vzorka rádiového zlúčeniny
Vzorka rádiového zlúčeniny Fyzický vzhľad
Rádio je strieborný biely kov, ktorý okamžite zafarbí žltý a stmavne, keď reaguje s dusíkom zo vzduchu, aby vytvoril jeho nitruro, RA3N2. Za to, že je tak ťažké manipulovať, existuje len málo fyzikálnych charakteristík polomeru, ktoré boli stanovené priamo.
Atómové číslo
88
Molárna hmota
226.03 g/mol
Bod topenia
Okolo 700 ° C. Táto veľkosť nebola schopná presne určiť.
Bod varu
Rádio vrie medzi 1100 a 1700 ° C. Táto veľká marža nepresnosti opäť odráža komplikácie manipulácie s takomto nestabilným kovom.
Hustota
5.5 g/cm3
Fúzne teplo
8.5 kJ/mol
Odparovanie
113 kj/mol
Oxidačný stav
Rádio má jediný oxidačný stav +2.
Elektronegativita
0.9. Táto hodnota verne zodpovedá silnému elektropozitívnemu charakteru polomeru.
Ionizačné energie
Po prvé: 509.3 kJ/mol
Po druhé: 979 kj/mol
Rádioaktivita
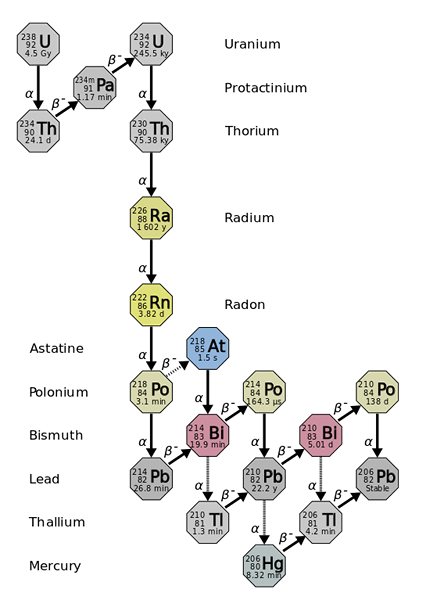 Polomer odvodzuje z rádioaktívneho poklesu ťažších a nestabilnejších prvkov, ako v prípade izotopu uránu-238. Zdroj: Používateľ: Tosaka, CC BY 3.0, cez Wikimedia Commons
Polomer odvodzuje z rádioaktívneho poklesu ťažších a nestabilnejších prvkov, ako v prípade izotopu uránu-238. Zdroj: Používateľ: Tosaka, CC BY 3.0, cez Wikimedia Commons Polomer je asi miliónkrát rádioaktívny ako urán. Je to hlavne kvôli skutočnosti, že z toho sa vyrábajú iné izotopy, napríklad 222Rn (vynikajúci obraz), ktorý sa zase rozpadá emitovaním a častíc na transformáciu do izotopu 218Po. Rádiová vzorka preto vydáva veľké množstvo a a p častíc-, ako aj γ lúče.
Napríklad gram rádiu trpí 3.7 · 1010 Dezintegrácie za sekundu, opatrenie, ktoré slúžilo na definovanie jednotky CI, ktorá sa nazýva Curie. Táto energia stačí na zahriatie vzorky 25 gramov vody 1 ° C za hodinu.
Ak sa pozoruje reťazec, bude zrejmé, že počiatočný izotop, 238U, máš a tón1/2 zo 4.5 rokov Giga (miliardy rokov); zatiaľ čo 226RA má a tón1/2 1600 rokov, ktoré tiež vyrábajú izotopy s tón1/2 iba dni, minúty a sekundy.
Rádioaktivita rádio a jeho zlúčenín je ionizujúca, takže fluorescenčné látky, dokonca aj okolité atómy, sa rozsvietia počas noci a sú schopné vyvolať výbušné reakcie. Táto vlastnosť je známa ako rádioluminiscencia.
Zlúčeniny a reaktivita
Keď sa soli alebo rádiové zlúčeniny zahrievajú v zapaľovačiku, vystrelia plameň Carmine. Takéto tuhé látky sú zvyčajne biele alebo bezfarebné, ale sú zafarbené žlté a nakoniec stmavnú v dôsledku rádioaktivity rádiových atómov. Ak majú nečistoty bária, môžu vykazovať ružové tóny.
Môže vám slúžiť: dvojitá substitučná reakciaRádiová chémia je veľmi podobná ako v Bario, akoby to boli dvaja neoddeliteľní bratia, Ra-ba. Obidve tvoria rovnaké soli, nerozpustné vo vode, s rozdielom, že slapky polomeru sú trochu nerozpustnejšie. Napríklad rádiový sulfát, satén4, Je nerozpustnejší ako sulfát bária, baso4; V skutočnosti je to najstarší sulfát, aký bol kedy známy: 2.1 mg z toho sa rozpustí len v 1 litri vody.
Na druhej strane, rádiový hydroxid, RA (OH)2, Je to najzavejšie a najzákladnejšie zo všetkých hydroxidov ich rovesníkov.
V roztoku, RA katióny2+, Namiesto toho, aby sa správali ako Lewis kyseliny, sú základné, pretože ich veľká veľkosť znemožňuje molekuly.
Chemická analógia medzi rádiom a báriom sa vracia k tomuto kovu ťažko oddeliteľné, pretože jeho soli koprecipitovali s množstvami bária.
Rádiové použitie/aplikácie
Svetelné hodinky
 Svetelné a fosforeskujúce hodinky boli v devätnástom storočí veľmi požadované, pre ich vizuálnu príťažlivosť a za obsah uznávaného rádia vo svojich obrazoch. Zdroj: Weapon95, CC BY-SA 3.0, cez Wikimedia Commons
Svetelné a fosforeskujúce hodinky boli v devätnástom storočí veľmi požadované, pre ich vizuálnu príťažlivosť a za obsah uznávaného rádia vo svojich obrazoch. Zdroj: Weapon95, CC BY-SA 3.0, cez Wikimedia Commons Najobľúbenejšie a najkontroverznejšie použitie polomeru malo byť použité ako prídavná látka pre obrazy hodiniek. Jeho atómy boli začlenené do pastovitých formulácií sulfidu zinočnatého, Zns, ktoré absorbovali rádioaktívne emisie a uvoľnili zelené a fosforescenčné svetlo. Farba bola aplikovaná na hodiny s hodinami (vynikajúci obrázok).
Problém tohto použitia bol v nepretržitej rádioaktívnej expozícii, ktorá ovplyvnila používateľov týchto hodiniek; Alebo horšie, pracovníci, ktorí ich maľovali v továrňach.
V roku 1924 začalo niekoľko zamestnancov, ktorí pracovali v maliarskom priemysle, neskôr známe ako Radio Girls (Radium Girls) schopný aplikovať rádioaktívnu farbu na hodiny.
To, plus neznalosť polomeru a malá etika neukladania opatrení na ochranu, ktoré zaručovali bezpečnosť pracovníkov, skončilo právnym škandálom, ktorý revolúciu v zákonoch o bezpečnosti povolania.
Môže vám slúžiť: Prenajmite si halogenuros: vlastnosti, získanie, príkladyRádiové obrazy sa prestali vyrábať v roku 1960; Aj keď dnes existuje niekoľko zberateľských exemplárov, ktoré ich majú na svojich povrchoch.
Raditor
 Radithorská fľaša vystavená v Národnom múzeu jadrovej vedy a histórie v Novom Mexiku. Zdroj: Sam Larussa zo Spojených štátov amerických, CC BY-SA 2.0, cez Wikimedia Commons
Radithorská fľaša vystavená v Národnom múzeu jadrovej vedy a histórie v Novom Mexiku. Zdroj: Sam Larussa zo Spojených štátov amerických, CC BY-SA 2.0, cez Wikimedia Commons Radithor bol jedným z mnohých farmaceutických a kozmetických produktov, ktoré vyhlásili rádiovú efektívnosť v boji proti tisícom a jedným chorým. Obsahoval mikrometrické rádiové množstvo, ktoré by malo vyliečiť všetky tráviace a endokrinné choroby. Avšak v roku 1932, po smrti Edena Byersa, jedného z jeho najpútavejších spotrebiteľov, Radithor opustil trh.
Rádioterapia
Nie všetky rádiové použitia boli senzacionistické, pseudovedecké a bezohľadné (alebo zločinci). Boli tam tiež skutočne prospešné pre zdravie, aspoň do nejakého času. Rádiové soli, RACL2 a rab2, Používajú sa pri liečbe rakoviny, konkrétne rakovina kostí.
Izotop 223RA, keď je zmätený vápnikovými iónmi v metabolizme, nakoniec ničí rakovinové bunky umiestnené v kostnej kosti.
Mnohé z terapeutických použití polomeru však boli nahradené bezpečnejšími, ekonomickými a efektívnymi izotopmi, ako napríklad 60Spol 137Cs.
Získanie
Rádio je jedným z prvkov, ktorých výroba je vzácna: len asi 100 gramov ročne na celom svete. Tony uránovej oranžovej farby, ako je napríklad pechblelenda (alebo uraninitová) ruda4-Baso4.
Saténová zmes4-Baso4 Premenilo sa to na ich príslušné chloridy, RACL2-Bacl2, oddelenie katiónov RA2+ frakčnými kryštalizáciami a nakoniec čistiacimi technikami iónovej chromatografie. RACL2 Je znížená elektrolýzou alebo redukciou kovovým hliníkom na 1200 ° C.
Izotopy
Všetky rádiové izotopy sú rádioaktívne. Štyria z nich existujú v prírode ako produkty rádioaktívneho rozkladu atómov 232Th, 235U a 238Alebo.
Tieto štyri izotopy sú: 223RA (tón1/2= 11.4 dni), 224RA (tón1/2= 3.64 dní), 226RA (tón1/2= 1600 rokov) a 228RA (5.75 rokov). Je zrejmé, že takmer všetky rádiové atómy pozostávajú z zmesí izotopov 226Ra a 228Ra, pretože ostatní sa rýchlo rozpadajú.
On 226RA je najstabilnejší zo všetkých izotopov rádia, všetci ostatní sú príliš nestabilní, s tón1/2 Menej ako dve hodiny.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Rádium. Zdroj: In.Wikipedia.orgán
- Redaktori Enyclopaedia Britannica. (2020). Rádium. Získané z: Britannica.com
- Rádioaktivita. (s.F.). Rádium: Rádioaktívne jadro, ktoré vytvorilo históriu. Obnovené z: rádioaktivity.EÚ.com
- Cantrill, v. (2018). Realita rádiu. Prírodná chem 10, 898. doi.org/10.1038/S41557-018-0114-8
- Elsevier B.Vložka. (2020). Rádium. Vedecký. Zdroj: ScienceDirect.com
- « Faktory erózie vetra, typy, dôsledky, príklady
- Geografia na kurzíva polostrova, krajiny, flóra, fauna, klíma »

