Čo je chemická kinetika?

- 1835
- 81
- Adrián Fajnor
Vysvetľujeme, čo je chemická kinetika, poriadok a rýchlosť reakcie a faktory, ktoré ovplyvňujú rýchlosť
Čo je chemická kinetika?
Ten chemická kinetika Je to vetva chémie, ktorá je zodpovedná za štúdium rýchlosti chemických reakcií, aké faktory ovplyvňujú túto rýchlosť a aké sú jednotlivé mechanizmy alebo kroky, prostredníctvom ktorých sa vyskytujú chemické reakcie.
Okrem toho nám umožňuje porozumieť mnohým aspektom chemických reakcií, ako je chemická rovnováha a aktivačná energia, a procesy katalýzy štúdií. To je obzvlášť dôležité vo viacerých aplikáciách, od biochémie po priemyselné inžinierstvo.
V strede kinetiky je rýchlosť reakcie, ktorú možno chápať ako rýchlosť, akou sa činidlá transformujú na výrobky. V chemickej kinetike však existuje oveľa presnejšia definícia.
Definícia reakčnej rýchlosti
Ak chcete poskytnúť úplnú definíciu reakčnej rýchlosti, ako sa používa v chemickej kinetike, začnime nasledujúcou generickou chemickou reakciou:
V tejto reakcii A a B predstavujú činidlá, C a D predstavujú výrobky, zatiaľ čo A, B, C a d Predstavujú príslušné stechiometrické koeficienty.
Rýchlosť reakcie (znázornená symbolom vložka) Označuje, ako rýchlo. Matematicky sa to vyjadruje takto:
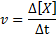
Kde δ [x] predstavuje zmenu molárnej koncentrácie druhu x (a, b, c alebo d) v časovom intervale Δt.
Je zrejmé, že čím rýchlejšie sa konzumuje ktorýkoľvek z reagencií, tým rýchlejšie sa budú konzumovať ostatné činidlá a čím rýchlejšie sa budú produkty vyskytnúť. Z tohto dôvodu je potrebné len definovať rýchlosť, pokiaľ ide o jeden z nich.
Môže vám slúžiť: metódy oddelenia homogénnych zmesíAby sa zabezpečilo, že výsledok výpočtu rýchlosti je vždy rovnaký, bez ohľadu na to, ktorý druh je definovaný rýchlosť, musí sa vždy rozdeliť medzi stechiometrický koeficient a umiestniť znamienko menej pred rovnicou, ak ide o činidlo. To znamená:
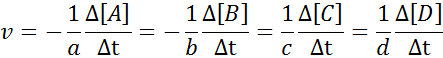
Príklad definície reakčnej rýchlosti
Vzhľadom na nasledujúcu chemickú reakciu:
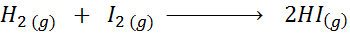
Napíšte definíciu reakčnej rýchlosti v závislosti od každého zapojeného druhu.
Riešenie:
Pokiaľ ide o H2:
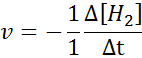
Pokiaľ ide o i2:
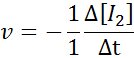
Pokiaľ ide o HI:
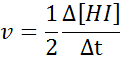
Zákon o rýchlosti a reakčný poriadok
Reakcie sa vyskytujú, keď sa atómy a molekuly navzájom zrážajú s dostatočnou energiou a správnou orientáciou. Pravdepodobnosť, že k tomu dôjde, sa zvyšuje, keď sú atómy a molekuly koncentrovanejšie.
Z tohto dôvodu rýchlosť takmer vždy závisí od koncentrácie reagencií. V niektorých prípadoch rýchlosť závisí aj od koncentrácie ktoréhokoľvek z produktov, ako aj od koncentrácie akéhokoľvek katalyzátora alebo inhibítora, ktorý je prítomný v prostredí.
Matematická rovnica, ktorá súvisí s rýchlosťou reakcie na koncentráciu rôznych druhov, sa nazýva “Zákon o rýchlosti”A v jednoduchších prípadoch má nasledujúcu formu:
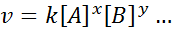
Kde klimatizovať Je to proporcionálna konštanta nazývaná konštantná rýchlosť, a exponenty A, B a akéhokoľvek iného druhu, ktoré sa objavujú v rovnici, sa nazývajú reakčné príkazy.
Podľa súčtu všetkých reakčných príkazov (ktoré sa nazýva globálny poriadok), je možné rozlíšiť rôzne typy reakcií. Líšia sa od toho, do akej miery koncentrácia ovplyvňuje rýchlosť, vo vzorci času potrebného na konzumáciu polovice reagencií (polovičný život) a spôsobu, akým sa koncentrácia činidiel v priebehu času mení (grafy [a] vs t. ).
-
Reakcie objednávky 0
Ak sú všetky exponenti v zákone o rýchlosti 0, rovnica zákona o rýchlosti sa zníži na:
Môže vám slúžiť: koordinovaný kovalentný odkaz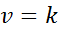
Inými slovami, sú to reakcie, ktoré sa vyskytujú konštantnou rýchlosťou a v ktorej rýchlosť nezávisí od koncentrácie akéhokoľvek činidla alebo produktu.
Objednať grafy 0
Graf [a] vs T reakčných reakcií 0 sú zostupné priame čiary.
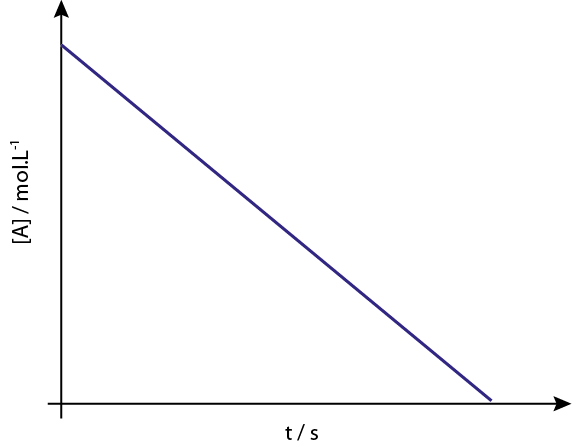
Legenda: Koncentračný graf verzus čas reakcie objednávky 0 dáva priamu čiaru.
Stredný život pre objednávku 0
Pre reakciu objednávky 0, čas polovice života (tón1/2) Je daný:
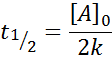
-
Reakcie 1. poriadku
V týchto reakciách sa rýchlosť lineárne mení s koncentráciou. Zákon o rýchlosti prvého poriadku je:
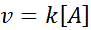
Grafika prvého poriadku
Graf [a] vs T reakcií prvého riadku je zostupný hyperbolas. Ak je však neperiánsky logaritmus koncentrácie (ln [a]) vs čas grafom, získa sa priamka.
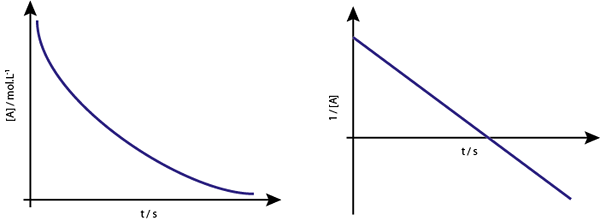 Koncentračný graf verzus čas reakcie Order 1 poskytuje hyperbolu, ale graf Neperiánskeho logaritmu koncentrácie verzus čas poskytuje čiaru
Koncentračný graf verzus čas reakcie Order 1 poskytuje hyperbolu, ale graf Neperiánskeho logaritmu koncentrácie verzus čas poskytuje čiaru Stredný život pre reakcie prvého riadku
Pre reakciu objednávky 1, tón1/2 Nezávisí to od počiatočnej koncentrácie a je daná:
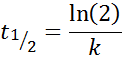
-
Reakcie druhého poriadku
Reakcia môže byť druhý poriadok vzhľadom na jediné činidlo alebo prvý poriadok vzhľadom na dva činidlá. V prvom prípade je zákon o rýchlosti daný:
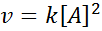
Grafika druhého poriadku
Graf [a] vs T reakcií druhého -rdéra je zostupný hyperbolas. Ak je však vynesený inverzia koncentrácie (1/[a]) vs čas, získa sa priamka.
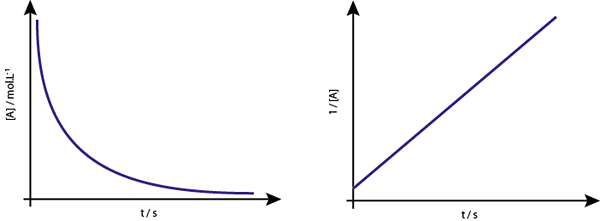 Graf koncentrácie verzus čas reakcie Order 2 poskytuje krivku podobnú zostupnej hyperbole, ale graf koncentrácie verzus čas poskytuje čiaru
Graf koncentrácie verzus čas reakcie Order 2 poskytuje krivku podobnú zostupnej hyperbole, ale graf koncentrácie verzus čas poskytuje čiaru Stredný život pre reakcie druhého poriadku
Pre reakciu objednávky 2, tón1/2 Je daný:
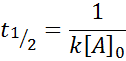
Faktory, ktoré ovplyvňujú rýchlosť reakcie
Teplota
Teplota vždy zvyšuje rýchlosť, pri ktorej sa reakcie vyskytujú, pretože frekvencia a energia, s akou sa molekuly navzájom zvyšujú. Závislosť od reakčnej rýchlosti s teplotou je daná Arrheniusovou rovnicou.
Môže vám slúžiť: Hydrid horčík: štruktúra, vlastnosti a použitiaTlak
Zvyšujúci sa tlak je ekvivalentný zvýšeniu koncentrácie všetkých druhov v reakčnom médiu (pre reakcie plynnej fázy), takže zvyšovanie tlaku má tendenciu zvyšovať rýchlosť reakcií.
Katalyzátory
Katalyzátory sú chemické látky, ktoré sa pridávajú do média len na zvýšenie reakčnej rýchlosti. Väčšina katalyzátorov funguje zmenou reakčného mechanizmu o jednom, ktorý vyžaduje nižšiu aktivačnú energiu.
Bežné príklady katalyzátora sú enzýmy v živých systémoch a niektoré kovy, ako sú platina a paladium.
Inhibítory
Inhibítory sú opakom katalyzátorov. Sú to látky, ktoré reagujú pomalšie. Antikorózne sú príklady inhibítorov, ktoré sa snažia znížiť rýchlosť koróznych reakcií, aby sa kovové povrchy zvýšili viac.


