Rovnocennosť

- 3269
- 896
- Tomáš Klapka
 Bod ekvivalencie je koncentrácia stechiometricky pridanej hodnoty rovnajúce sa množstvom analytu
Bod ekvivalencie je koncentrácia stechiometricky pridanej hodnoty rovnajúce sa množstvom analytu Aký je bod rovnocennosti?
On rovnocennosť Je to jedna, v ktorej boli úplne reagované dve chemické látky. Pri reakciách na báze kyseliny tento bod naznačuje, kedy bola neutralizovaná celá kyselina alebo báza.
Tento koncept je každý deň v objemových stupňoch alebo oceneniach a je určený jednoduchými matematickými výpočtami.
V tejto súvislosti je stupeň procesom, v ktorom sa starostlivo pridáva objem známeho koncentračného roztoku, nazývaný titulárny, do neznámeho koncentračného roztoku, aby sa získala jeho koncentrácia.
Použitie indikátora pH umožňuje poznať okamih, v ktorom stupeň končí. Indikátor sa pridá do riešenia, ktoré sa nazýva na kvantifikáciu koncentrácie, ktorú chcete poznať.
Indikátor kyslej bázy je chemická zlúčenina, ktorej farba závisí od koncentrácie vodíka alebo pH média.
Zmena farby indikátora označuje koncový bod stupňa, aj keď nie bod rovnocennosti. V ideálnom prípade sa musia oba body zhodovať, ale v skutočnosti sa môže vyskytnúť zmena farby po niekoľkých kvapkách po dokončení neutralizácie kyseliny alebo základne.
Aký je bod rovnocennosti?
Roztok neznámej koncentračnej kyseliny umiestnenej do banky.
Výber indikátora sa musí vykonať takým spôsobom, aby zmenil farbu v bode, že reagovalo rovnaké množstvo chemických ekvivalentov titračujúceho roztoku a neznámeho koncentračného roztoku.
Toto je bod rovnocennosti, zatiaľ čo bod, v ktorom indikátor mení farbu, sa nazýva koncový bod, kde titul končí.
Môže vám slúžiť: hypotonické riešenie: komponenty, príprava, príkladyZáverečný bod
Ionizácia alebo disociácia indikátora je znázornená takto:
Hin +h₂o v- + H3Ani+
A preto má konštantnú ka
Ka = [h3Ani+] [V-] / [Hin]
Vzťah medzi indikátorom nezadaným (HIN) a disociovaným indikátorom (v-) Určte farbu indikátora.
Pridanie kyseliny zvyšuje koncentráciu HIN a vytvára farbu 1 indikátora. Medzitým pridanie základne uprednostňuje zvýšenie koncentrácie disociovaného indikátora (v-) (Farba 2).
Je žiaduce, aby sa bod rovnocennosti zhodoval s koncovým bodom. Za týmto účelom sa vyberie indikátor s intervalom zmeny farby, ktorý obsahuje bod rovnocennosti. Okrem toho ide o zníženie akejkoľvek chyby, ktorá spôsobuje rozdiel medzi bodom ekvivalencie a koncovým bodom.
Štandardizácia alebo hodnotenie roztoku je proces, v ktorom sa stanoví presná koncentrácia roztoku. Je to metodologicky stupeň, ale sledovaná stratégia je iná.
Roztok primárneho štandardu je umiestnený do banky a titulárny roztok, ktorý je štandardizovaný.
Rovnocennosť titrácie silnej kyseliny so silnou bázou
100 ml 0,1 M HCl sa vloží do banky a postupne sa pridáva pomocou byrety, 0,1 M roztoku NaOH, ktorý určuje zmeny pH roztoku, ktorý spôsobuje kyselinu chlorovodíkovú.
Spočiatku pred pridaním NaOH je pH roztoku HCL 1.
Pridá sa silná báza (NaOH) a pH sa postupne zvyšuje, ale zostáva kyslým pH, pretože nadmerná kyselina určuje toto pH toto pH.
Môže vám slúžiť: jodid draselný (KI): Štruktúra, vlastnosti, získanie, použitie, rizikáAk NaOH pokračuje, je čas, keď sa dosiahne bod ekvivalencie, kde je pH neutrálne (pH = 7). Kyselina reagovala so základnou konzumáciou, ale zatiaľ nie je prebytok bázy.
Koncentrácia chloridu sodného prevláda, čo je neutrálna soľ (ani Na+ ani CL- sú hydrolyzované).
Ak NaOH pokračuje, pH sa naďalej zvyšuje a stáva sa základnejším ako bod ekvivalencie, pretože koncentrácia NaOH prevláda.
V ideálnom prípade by sa zmena indikátora farby mala vyskytnúť na pH = 7, ale v dôsledku náhleho tvaru titulkovej krivky sa môže použiť fenolftaleín, ktorý zmení svetloružovú farbu na pH okolo 8.
Krivka stupňa založenej na páde
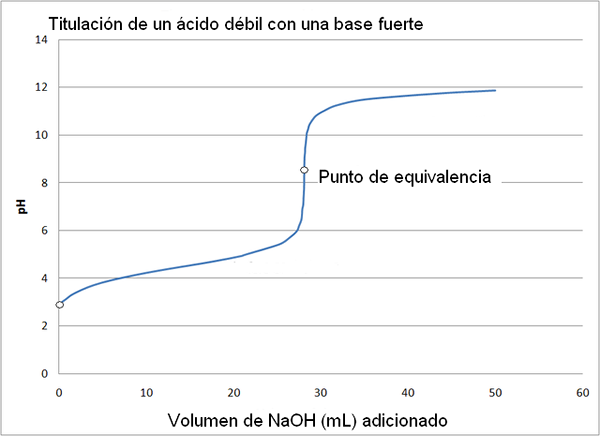 Slabá kyselina a silná krivka titrácie báz. Zdroj: Wikimedia Commons
Slabá kyselina a silná krivka titrácie báz. Zdroj: Wikimedia Commons Titračná krivka silnej kyseliny so silnou bázou je podobná ako v prípade horného obrázka. Jediným rozdielom medzi oboma krivkami je, že prvý má oveľa náhlejšiu zmenu pH, zatiaľ čo v titračnej krivke slabej kyseliny so silnou základňou je zrejmé, že zmena je postupnejšia.
V tomto prípade je nazvaná slabá kyselina, napríklad kyselina octová (CH3COOH) so silnou základňou, hydroxid sodným (NaOH). Reakcia, ktorá sa vyskytuje v stupni, sa môže schematizovať takto:
Naoh +ch3Cooh => ch3Coo-Nat+ + H₂o
V tomto prípade sa roztok acetátu vyrovnáva s PKA = 4,74. Vanknutý región je možné vidieť pri miernej a takmer nepostrehnuteľnej zmene pred pH 6.
Môže vám slúžiť: aminoskupina (NH2): štruktúra, vlastnosti, príkladyBod ekvivalencie, ako je uvedené v obraze, je okolo 8,72 a nie 7. Je to preto, že Cho3Coo- Je to anión, ktorý po hydrolyzaru generuje OH-, Ktoré základy pH:
Chvály3Coo- + H₂o ch3COOH +OH-
Etapa
Titrácia kyseliny octovej hydroxidom sodným sa dá rozdeliť do 4 štádií na analýzu.
- Predtým, ako začnete pridávať bázu (NaOH), pH roztoku je kyslé a závisí od disociácie kyseliny octovej.
- Keď sa pridá hydroxid sodný, vytvára sa roztok tlmenia acetátu, ale rovnako sa zvýši tvorba konjugovanej acetátovej bázy, čo so sebou prináša zvýšenie roztoku roztoku roztoku.
- PH bodu ekvivalencie sa vyskytuje na pH 8,72, čo je úprimne zásadité.
Bod ekvivalencie nemá konštantnú hodnotu a líši sa v závislosti od zlúčenín zapojených do stupňa.
- Pokračovaním v pridávaní NaOH, po dosiahnutí bodu ekvivalencie sa pH zvyšuje v dôsledku prebytočného hydroxidu sodného.
Výber ukazovateľa podľa bodu rovnocennosti
Fenolftaleín je užitočný pri určovaní bodu ekvivalencie v tomto stupni, pretože má svoj farebný bod odbočky v pH okolo 8, ktorý spadá do oblasti pH titrácie kyseliny octovej, ktorá obsahuje bodovú ekvivalenciu (pH = 8,72).
Na druhej strane, metyl červená nie je užitočná pri určovaní bodu rovnocennosti, pretože mení farbu v intervale pH 4,5 až 6,4.
Odkazy
- Helmestine, Anne Marie. Definícia bodu rovnocennosti. Zotavené z Thoughtco.com
- Rozdiel medzi koncovým bodom a bodom rovnocennosti. Získané z rozdielu medzi.slepo
- Bod rovnocennosti: Definícia a výpočet. Zotavená štúdia.com

