Typy a funkcie proteolýzy
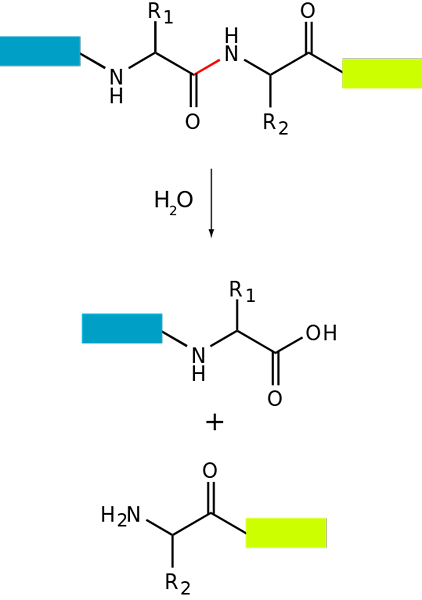
- 3543
- 297
- MUDr. Miloslav Habšuda
Ten Proteolýza o Degradácia proteínov je proces, ktorým môžu byť bunkové proteíny úplne degradované (dokonca aj ich zložkové aminokyseliny) alebo čiastočne (produkujúce peptidy). To znamená, že pozostáva z hydrolýzy jedného alebo viacerých peptidových väzieb, ktoré udržiavajú svoje aminokyseliny pohromade.
Tento proces sa môže vyskytnúť vďaka účasti iných proteínov s enzymatickou aktivitou, ktorej aktívne miesta sa vyskytuje hydrolýza väzieb. Môže sa vyskytnúť aj neinzymatickými „metódami“, napríklad pôsobením tepla alebo látok s extrémnym pH (veľmi kyslé alebo veľmi základné).
 Základná schéma proteolýzy proteínu (Zdroj: FDARDEL [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons)
Základná schéma proteolýzy proteínu (Zdroj: FDARDEL [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)] Via Wikimedia Commons) Degradácia proteínov sa vyskytuje u baktérií, ako aj u zvierat a rastlín, ale je obzvlášť bežná u zvierat, najmä na úrovni tráviaceho systému, pretože závisí od trávenia a absorpcie čreva proteínov požitých stravou.
Okrem toho je proteolýza nanajvýš dôležitá pre funkčné udržiavanie a reguláciu viacerých bunkových procesov a tiež súvisí s elimináciou proteínov, ktoré majú transláciu, skladanie, balenie, dovoz, operáciu atď.
Je dôležité poznamenať, že je to ireverzibilný a mimoriadne účinný proces, ktorý tiež pracuje v „regulácii regulátorov“, pretože nielen eliminuje tie proteíny, ktoré majú „priame“ biologické aktivity, ale aj tie, ktoré regulujú iné proteíny alebo expresiu zodpovedajúcich génov.
[TOC]
Typy proteolýzy
Interné proteíny bunky môžu byť náhodne alebo selektívne degradované alebo čo je rovnaké, kontrolované alebo nie. Na druhej strane, ako už bolo spomenuté, tento proces sa môže vyskytnúť prostredníctvom špeciálnych enzýmov alebo v dôsledku podmienok prostredia definovaných ako kyslé a/alebo alkalické pH.
Môže vám slúžiť: tkanivo epitelového povlakuJe dôležité spomenúť, že akýkoľvek správne preložený proteín, zložený alebo balený skrýva jednu alebo viac sekvencií degradačných signálov, ktoré sú „kryptické“ a ktoré môžu byť vystavené, keď je proteín štrukturálne narušený teplotou, pH, pH atď.
Ubikvitinačná proteolýza
Ubikvitinácia (ubikvitín-proteozómový systém) je systém, pomocou ktorého sa proteíny môžu selektívne hydrolyzovať po špecifickom vyzničení na degradáciu, čo sa môže vyskytnúť v cytosóle aj v bunkovom jadre.
Tento systém má schopnosť rozpoznávať a ničiť proteíny označené v jadre a v cytosóle, ako aj degradovať proteíny, ktoré sa počas jeho translokácie z cytosolu do endoplazmatického retikula nezahŕňajú správne.
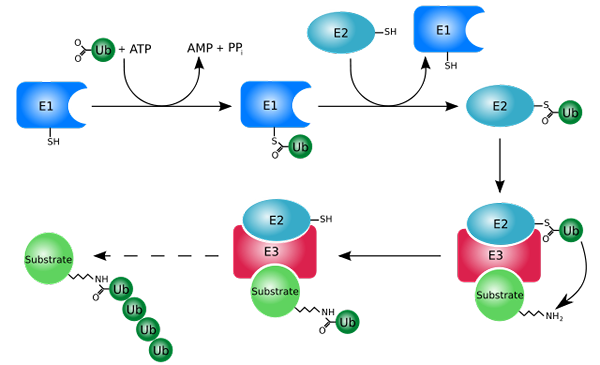 Proces označovania s ubikvitinami (ubikvitinácia) (Zdroj: Rogerdodd [CC BY-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/)] Via Wikimedia Commons)
Proces označovania s ubikvitinami (ubikvitinácia) (Zdroj: Rogerdodd [CC BY-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/)] Via Wikimedia Commons) Funguje to hlavne pridaním alebo konjugáciou „bielych“ proteínov do malého proteínu alebo peptidu 76 aminokyselinových odpadov, lepšie známe ako ubikvitín. Tieto „označené“ proteíny ubikvitináciou sú degradované v malých fragmentoch proteozómom 26S, čo je proteáza niekoľkých podjednotiek.
Proteolýza
Autofágia považujú aj niektorí autori za formu proteolýzy, s rozlíšením, že k tomu dochádza vo vnútri uzavretej membránovej kompartmentu, ktorý je zameraný na lyzozómy (v živočíšnych bunkách), kde proteíny obsiahnuté vo vnútri sú degradované lyzozomálnymi proteázami.
Neenzymatická proteolýza
Teplota, pH a dokonca aj koncentrácia solí média môžu spôsobiť hydrolýzu peptidových väzieb, ktoré udržiavajú aminokyseliny rôznych typov proteínov, ktoré sa vyskytujú destabilizáciou a prerušením väzieb.
Funkcia
Proteolýza má veľa funkcií v živých organizmoch. Obzvlášť to súvisí s výmenou bielkovín.
Môže vám slúžiť: ribozómy: charakteristiky, typy, štruktúra, funkcieProteíny majú polovičný život, ktorý sa mení od niekoľkých sekúnd do niekoľkých mesiacov, a produkty ich degradácie, či už regulované alebo nie, sprostredkované enzýmami alebo nie, sa všeobecne opätovne použijú na syntézu nových proteínov, ktoré pravdepodobne plnia rôzne funkcie.
To sa deje s proteínmi, ktoré sa konzumujú potravou, ktoré sú degradované v gastrointestinálnom trakte proteázami vrátane tripsínu a pepsinu; ako aj s niektorými bunkovými proteínmi, keď bunky nemajú dostatok potravy na prežitie.
Intracelulárne proteolytické systémy detekujú a eliminujú „abnormálne“ proteíny, ktoré sú potenciálne toxické pre bunky, pretože môžu interagovať s „fyziologicky nevhodnými“ ligandami, okrem výroby agregátov, ktoré spôsobujú mechanické a fyzikálne prekážky pre normálne bunkové procesy.
Akumulácia abnormálnych proteínov vo vnútri buniek, buď v dôsledku defektov vo vnútornom proteolytickom systéme alebo z iných dôvodov, je to, čo mnohí vedci považujú za jednu z hlavných príčin starnutia u mnohobunkových živých bytostí.
V imunitnom systéme
Čiastočná proteolýza mnohých proteínov z exogénnych alebo cudzích zdrojov, ako je napríklad napadnutie mikroorganizmov, je základným procesom pre systém imunitnej reakcie, pretože T lymfocyty rozpoznávajú krátke fragmenty, produkt proteolýzy (peptidy) Sada povrchových proteínov.
Tieto peptidy môžu pochádzať zo systému ubikvitinácie, autofagických procesov alebo nekontrolovaných proteolýzových udalostí.
Iné funkcie
Ďalšou funkciou obmedzenej alebo čiastočnej proteolýzy je modifikácia novovytvorených proteínov, ktorá funguje ako „príprava“ pre jeho intra-extracelulárne funkcie. To je pravda napríklad pre určité hormóny a proteíny zapojené do rôznych metabolických procesov.
Môže vám slúžiť: lymfaopoyéza: Charakteristiky, štádiá, reguláciaProgramovaná bunková smrť (apoptóza) tiež závisí, do veľkej miery od proteolýzy „špecifickej“, obmedzeného alebo čiastočného intracelulárneho proteínov, ktorý je sprostredkovaný vodopádom špecifických proteáz nazývaných kaspázy.
Extracelulárne regulačné systémy tiež závisia od miesta špecifickej proteolýzy a najvýznamnejším príkladom je koagulácia v krvi.
Všeobecná alebo úplná proteolýza tiež plní primárne funkcie pre selektívnu degradáciu tých proteínov, ktorých koncentrácia musí byť starostlivo kontrolovaná v závislosti od fyziologického, metabolického alebo bunkového vývoja.
V rastlinách
Rastliny tiež používajú proteolytické procesy na kontrolu mnohých fyziologických a vývojových aspektov. Funguje napríklad pri udržiavaní intracelulárnych podmienok av mechanizmoch reakcie na stresujúce podmienky, ako je sucho, slanosť, teplota,.
Ako aj u zvierat, proteolýza v zelenine. V týchto organizmoch je proteolýza ubikvitináciou jednou z najdôležitejších.
Odkazy
- Alberts, b., Bray, D., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2013). Základná bunková biológia. Girlandská veda.
- Maurizi, m. R. (1992). Proteaseses a degraion proteínov v Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, a. (2005). Regulovaná degradácia proteínov. Trendy v biochemických vedách, 30 (6), 283-286.
- Viestra, R. D. (Devätnásť deväťdesiat šiestich). Proteolýza v rastlinách: mechanizmy a funkcia. Pri post-transkripčnej kontrole génovej expresie v rastlinách (str. 275-302). Springer, Dordrecht.
- Vlk, D. H., & Messen, r. (2018). Mechanizmy proteolýzy regulácie buniek, veľké prekvapenie. Febs Letters, 592 (15), 2515-2524.
- « Charakteristiky paradise ave, biotop, vlastnosti, reprodukcia, starostlivosť
- Charakteristiky trypanosoma cruzi, životný cyklus, choroby, príznaky »

