Štruktúra pyruvátovej kinázy, funkcia, regulácia, inhibícia
- 5068
- 448
- Gabriel Bahna
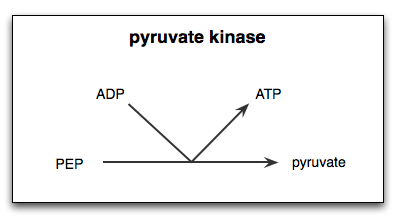
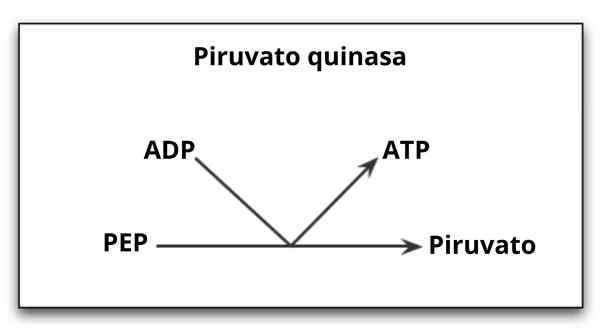 Reakcia katalyzovaná enzýmom pyruvato kinázou
Reakcia katalyzovaná enzýmom pyruvato kinázou Čo je kinázový pyruvát?
Ten Pyruvát kináza (Pyk) Je to enzým, ktorý katalyzuje posledný krok glykolytickej cesty, čo znamená ireverzibilný prenos fosfátovej skupiny fosfoenolpiruvátovej (PEP) molekuly smerom k molekule ADP, čo vedie k syntéze ATP molekuly a inej pyruvovej kyseliny alebo kyseliny alebo pyruvát.
Pyruvát takto produkovaný neskôr sa zúčastňuje na rôznych katabolických a anabolických (biosyntetických) trasách: môže byť dekarboxylovaný, aby sa vytvoril acetyl-CoA, karboxylovaný na produkciu oxalacetátu, transaminovaný za produkciu alanínu, oxidovaného na produkciu kyseliny mliečnej alebo môže byť nasmerovaný smerom k glukónogenéz glukóza.
Pretože sa podieľa na glykolýze, tento enzým je nanajvýš dôležitý pre metabolizmus uhľohydrátov mnohých organizmov, jednobunkových a mnohobunkových, ktoré ho používajú ako hlavná katabolická cesta na získanie energie.
Príkladom prísne závislých buniek glykolýzy na získanie energie je erytrocyty cicavcov, pre ktoré môže mať deficit v ktoromkoľvek z enzýmov, ktoré sa zúčastňujú na tejto trase.
Štruktúra pyruvátu kinázy
U cicavcov boli opísané štyri izoformy enzýmu pyruvát kinázy:
- Pkm1, Typické vo svaloch
- Pkm2, Iba u plodov (oba produkty alternatívneho spracovania rovnakej Messenger RNA)
- Pkl, prítomné v pečeni a
- PKR, prítomný v erytrocytoch (obidve kódované rovnakým génom, Pklr, ale prepisované rôznymi promótormi).
Analýza vykonaná na štruktúru rôznych enzýmov pyruvát kinázy (vrátane týchto 4 cicavcov) však vykazuje veľkú podobnosť vo všeobecnej štruktúre, ako aj s ohľadom na architektúru aktívneho miesta a regulačných mechanizmov.
Môže vám slúžiť: koloniálne združenia: Charakteristiky, typy a príkladyVšeobecne je to enzým s molekulovou hmotnosťou 200 kDa, ktorý sa vyznačuje tetramererkou zloženou zo 4 identických proteínových jednotiek, viac alebo menej 50 alebo 60 kDa a každá so 4 domami, konkrétne:
- Doména špirálovitý Malý na konci N-terminálu (neprítomný v bakteriálnych enzýmoch)
- Doména “Do“, Identifikované topológiou 8 zložených β plátkov a 8 haly α
- Doména “B“, Vložená medzi zložené beta lamina číslo 3 a doména alfa domény„ A “
- Doména “C“, Ktorý má a+β topológiu
 Molekulárna štruktúra enzýmu pyruvátkinázy
Molekulárna štruktúra enzýmu pyruvátkinázy V tetraméroch kinázového pyruvátu rôznych organizmov boli detegované tri miesta: aktívne miesto, miesto efektora a väzbové miesto aminokyselín. Aktívne miesto týchto enzýmov je medzi doménami A a B, v blízkosti „efektora“, ktorý patrí do domény C.
V Tetrámero tvoria domény D „malé“ rozhranie, zatiaľ čo domény vo forme väčšie rozhranie.
Funkcia pyruvátu kinázy
Ako už bolo spomenuté, kinázový pyruvát katalyzuje posledný krok glykolytickej trasy, to znamená prenos fosfátovej skupiny z fosfoenolpiruvátu (PEP) do molekuly ADP na produkciu ATP a pyruvátu alebo pyruvovej kyseliny.
Produkty reakcie katalyzované týmto enzýmom sú nanajvýš dôležité pre rôzne metabolické kontexty. Pyruvát sa dá použiť rôznymi spôsobmi:
- Za aeróbnych podmienok, to znamená v prítomnosti kyslíka alebo sa zúčastňujte napríklad na iných anabolických trasách, ako je napríklad biosyntéza mastných kyselín.
- V neprítomnosti kyslíka alebo anaerobiózy môže byť pyruvát použitý pomocou enzýmu laktátu dehydrogenázy na výrobu kyseliny mliečnej (oxidácie) prostredníctvom procesu známeho ako „mliečna fermentácia“.
- Okrem toho sa môže pyruvát previesť na glukózu glukoneogenézou, na alanín transaminázovým alanínom, v oxalacetáte karboxylázovým pyruvátom atď.
Je dôležité si uvedomiť, že v reakcii katalyzovanej týmto enzýmom sa vyskytuje čistá syntéza ATP, ktorá sa počíta na glykolýzu, ktorá produkuje každou molekulami pyruvátov glukózy 2 pyruvát a 2 ATPP.
Z tohto hľadiska má teda enzým kinázový pyruvát základnú úlohu v mnohých aspektoch bunkového metabolizmu, ktorý sa tak používa ako terapeutický cieľ pre mnoho patogénov ľudskej bytosti, medzi ktorý.
Regulácia
Kinázový pyruvát je mimoriadne dôležitý enzým z hľadiska metabolizmu buniek, pretože je to ten, ktorý tvorí poslednú zlúčeninu vyplývajúcu z katabolizmu glukózy: pyruvát.
Okrem toho, že je jedným z troch naj regulovanejších enzýmov celej glykolytickej trasy (ďalšie dve hexoquináza (HK) a fosfofrucerachináza (PFK)), je kinázový pyruvát veľmi dôležitým enzýmom pre kontrolu metabolického toku a produkcie ATP prostredníctvom ATP prostredníctvom glykolýza.
Je aktivovaný fosfoenolpiruvátom, jedným z jeho substrátov (homotropná regulácia), ako aj inými mono- a diposforylovanými cukrami, hoci jeho regulácia závisí od typu izoenzýmu, ktorý sa považuje.
Niektoré vedecké texty naznačujú, že regulácia tohto enzýmu tiež závisí od jeho architektúry „multidominium“, pretože jej aktivácia závisí od niektorých rotácií v doménach podjednotiek a zmien v geometrii aktívneho miesta.
Pre mnoho organizmov závisí átrosterická aktivácia kinázového pyruvátu od fruktózy 1,6-bifosfátu (F16bp), ale to neplatí pre rastlinné enzýmy. Ostatné enzýmy sú tiež aktivované cyklickým AMP a glukózou 6-fosfát.
Môže vám slúžiť: ruky: Charakteristiky, štruktúra, funkcieOkrem toho sa ukázalo, že aktivita väčšiny študovaných pyruvátových kináz závisí od prítomnosti monovalentných iónov, ako je draslík (K+) a dvojmocné ióny, ako sú horčík (Mg+2) a mangán (Mn+2).
Inhibícia
Kinázový pyruvát je inhibovaný hlavne fyziologickým efektorom, takže tieto procesy sa značne líšia medzi rôznymi druhmi a dokonca medzi typmi buniek a tkanivámi toho istého organizmu.
U mnohých cicavcov má glukagón, epinefrín a AMPC inhibičné účinky na aktivitu pyruvátu kinázy, účinky, ktoré môžu byť pôsobené inzulínom.
Okrem toho sa preukázalo, že niektoré aminokyseliny, ako je fenylalanín, môžu mať akcie, ako sú konkurenčné inhibítory tohto enzýmu v mozgu.

