Štruktúra oxalátu sodného (Na2C2O4), vlastnosti, použitia, riziká

- 5017
- 1565
- Václav Višňovský
On oxalát sodný Je to organická zlúčenina tvorená dvoma sodnými iónmi a oxalátovým iónom. Jeho chemický vzorec je NA2C2Ani4 alebo tiež na2(COO)2. Je to sodná soľ kyseliny oxalovej alebo kyseliny etanodioovej. Potom2C2Ani4 Je to kryštalická biela pevná látka a jej vodné roztoky sú základné (alkalické).
Oxalát sodný je prítomný v rastlinách a zelenine. V ľudskej bytosti sa prirodzene vytvára z jej konjugovanej kyseliny kyseliny, ktorá je zase produkovaná určitými metabolickými procesmi.
 Oxalát sodný na sodný2(COO)2 tuhý. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Oxalát sodný na sodný2(COO)2 tuhý. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Potom2C2Ani4 Používa sa v laboratóriách chemickej analýzy ako redukčné činidlo (opak oxidantu). Tiež na umožnenie testov určitých organických zlúčenín počas čistenia odpadových vôd.
Používa sa na elimináciu chlórfluórokarbónov odpadu (CGC), ktorý poškodzuje ozónovú vrstvu. Je tiež surovinou, aby sa ekonomicky získala kyselina oxalová.
Vzhľadom na vysoký obsah oxalátu sodného v niektorých jedlých zelenine by ľudia, ktorí majú tendenciu vytvárať výpočty alebo obličkové kamene, by sa mali vyhnúť konzumácii takýchto potravín. Je to preto, že kamene sa zvyčajne tvoria oxalátmi.
[TOC]
Štruktúra
Oxalát sodný sa skladá z dvoch katiónov sodného+ a anión oxalátu (COO)22-. Oxalátový anión tvorí postupne dvoma COO- Pripojte sa cez dva atómy uhlíka: -Ooc-coo-.
V pevnom oxaláte sodného má oxalát anión plochý tvar. To znamená, že uhlíky aj kyslík sa nachádzajú v rovnakej rovine.
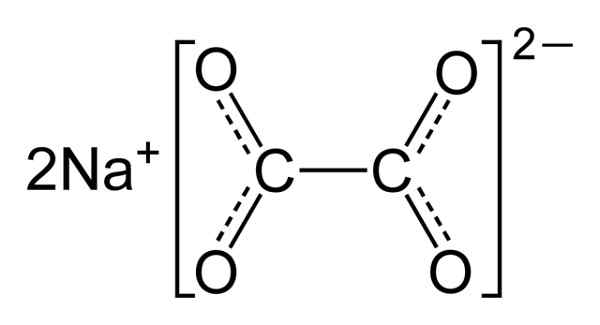 Chemická štruktúra oxalátu sodného2(COO)2. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Chemická štruktúra oxalátu sodného2(COO)2. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Menovanie
- Oxalát sodný
- Oxalát dysodia
- Sodná soľ kyseliny etanodioovej
Vlastnosti
Fyzický stav
Kryštalická biela pevná látka.
Molekulová hmotnosť
134,0 g/mol
Hustota
2,27 g/cm3 pri 20 ° C.
Rozpustnosť
Vodné rozpustné: 3,7 g/100 ml pri 20 ° C.
pH
Jeho vodné roztoky sú základné (alkalické), pretože oxalátový anión má tendenciu užívať vodné protóny a opúšťať ióny bezplatne-.
Môže vám slúžiť: Neón: História, vlastnosti, štruktúra, riziká, použitieChemické vlastnosti
Môže neutralizovať kyseliny a reakcie sú exotermické, to znamená, že vydávajú teplo.
Slúži ako redukčné činidlo a v týchto reakciách vytvára CO oxidu uhličitého2.
Má vlastnosť vstupu do niekoľkých kovových iónov, ako napríklad viera železa železa2+ a železitá viera3+.
Získanie
Podľa konzultovaného zdroja je možné získať oxalát sodný oxidujúci kyslík alebo2 Pri teplote asi 250 ° C v koncentrovanom roztoku hydroxidu sodného NaOH.
Prítomnosť v prírode
Oxalát sodný je prítomný v mnohých rastlinách a zelenine, ako je napríklad mangold, špenát a Ruibarbo, a v zrnách, ako sú sójové bôby, medzi mnohými inými rastlinnými výrobkami.
 Špenát má veľa oxalátu sodného. Autor: Aline Ponce. Zdroj: Pixabay.
Špenát má veľa oxalátu sodného. Autor: Aline Ponce. Zdroj: Pixabay. Jeho konjugovaná kyselina kyselina kyselina sa vyskytuje v ľudskom organizme metabolizmom kyseliny glykolovej alebo kyseliny askorbovej. Akonáhle je vyrobený, nie je metabolizovaný, ale vylučuje sa močom s oxalátom.
 Ruibarbo obsahuje oxalát sodný. Autori: s. Hermann & F. Bohatstvo. Zdroj: Pixabay.
Ruibarbo obsahuje oxalát sodný. Autori: s. Hermann & F. Bohatstvo. Zdroj: Pixabay. Žiadosti
V laboratóriách chemickej analýzy
Používa sa ako chemické činidlo, zvyčajne ako redukčné činidlo, napríklad na štandardizáciu roztokov permanganátov draslíka, to znamená, že presne určí, koľko sodíka má permanganát sodíka.
Pri ničení chlórfluórokarbónov
Oxalát sodný sa používa na deštrukciu chlórofluórokarbónov (CFC). Tieto zlúčeniny CFC boli jednou z tých, ktorí sú zodpovední za zničenie ozónovej vrstvy planéty (ktorá nás chráni pred ultrafialovým žiarením).
V roku 1996 niektorí vedci navrhli použitie oxalátu sodného na ich odstránenie, pretože ľahko reaguje s CFC pri teplotách 270-290 ° C, vďaka čomu sú neškodné produkty smerom k ozónovej vrstve.
Reakcia oxalátu sodného s CFC môže byť regulovaná, aby sa získalo halogénované aromatické uhľovodíky, ktoré nie sú škodlivé pre ozónovú vrstvu, ale sú užitočnými zlúčeninami v chemickom priemysle.
Môže vám slúžiť: Propylénglykol: Štruktúra, vlastnosti, syntéza a použitieTáto reakcia sa môže tiež priviesť na maximálne a premeniť celý CFC na fluorid sodný NAF, chlorid sodný Soll, elementárny uhličitý a oxid uhličitý2.
 Ozónová vrstva planéty nás chráni pred ultrafialovými lúčmi Slnka. Oxalát sodný vám umožňuje eliminovať zlúčeniny CFC, ktoré ho poškodzujú. Autor: One94. Zdroj: Pixabay.
Ozónová vrstva planéty nás chráni pred ultrafialovými lúčmi Slnka. Oxalát sodný vám umožňuje eliminovať zlúčeniny CFC, ktoré ho poškodzujú. Autor: One94. Zdroj: Pixabay. Pri určovaní dôležitých parametrov pri čistení odpadových vôd
Zistilo sa, že oxalát sodný je užitočný na meranie množstva a tried organických zlúčenín, ktoré vylučujú mikroorganizmy kalu používané na liečbu odpadovej vody.
Miera takýchto zlúčenín je dôležitá na určenie ich funkcie počas spracovania odpadovej vody, pretože ľahkosť oddelenia blata od vody závisí od nich.
Pri použití oxalátu sodného sa zabráni nepríjemnostiam iných metód.
Na získanie kyseliny oxalovej
Na výrobu kyseliny oxalovej h sa používa surový oxalát sodného z odpadu z určitých procesov2C2Ani4 vo veľkom množstve.
Táto metóda používa kal z procesu Bayer na ošetrenie bauxitu (hliníkový minerál). V Bayerovom procese sa bauxitu ošetrí hydroxidom sodným NaOH, aby sa rozpustil hlinit tohto minerálu.
V procese rozpustenia hlinitého sú určité organické zlúčeniny prítomné v mineráli, ako sú kyseliny humínovej2C2Ani4.
Tento oxalát sodný je začlenený do bahna s hliníkovými zlúčeninami. Na jeho očistenie sa zostava rozpustí, filtruje sa a prechádza cez kyslý výmenný stĺpec iónov typu kyslého typu.
V kolóne je živica kyseliny sulfónovej RSO3H, kde sa vymieňajú kovové ióny+ vodíkovými iónmi h+, Takže dostanete kyselinu oxalovú h2C2Ani4.
Rso3H + na2C2Ani4 ⇔ RSO3Na + NAHC2Ani4
Môže vám slúžiť: uhličitan draselný (K2CO3): štruktúra, vlastnosti, použitia, získanieRso3H + NAHC2Ani4 ⇔ RSO3Na + h2C2Ani4
Toto je ekonomický proces a získaná kyselina oxalová má prijateľnú čistotu.
Na odstránenie nechcených zlúčenín
Konjugovaná kyselina oxalát sodný, kyselina oxalová h2C2Ani4, Používa sa na rozpustenie určitých druhov odpadu a vložiek.
Kyselina kyselina oxalová, ktorá sa stáva oxalátom, sa používa ako komplexné alebo zrážajúce činidlo napríklad počas spracovania odpadu z rôznych jadrových palív.
Kyselina oxalová sa tiež používa na odstránenie vložiek minerálov a oxidov železa v potrubiach a iných zariadeniach, je to kvôli jej schopnosti silne pripojiť sa k viere železých iónov2+ ako viera železitých iónov3+ formovanie oxalátov.
Riziká
Ak je oxalát sodný vdychovaný alebo priamo požívaný. Vytvára zvracanie, silné čistenie, slabý pulz, kardiovaskulárny kolaps, neuromuskulárne príznaky a poškodenie obličiek.
Ľudia, ktorí majú tendenciu vytvárať výpočty v obličkách v dôsledku akumulácie oxalátu v moči, by sa mali vyhnúť konzumácii zeleniny s vysokým obsahom rozpustných oxalátov, ako je sodík.
Oxalát sodný vo vysokom množstve potravín pri dosahovaní moču sa viaže na vápnik prítomný v tomto a môže produkovať výpočty alebo kamene oxalátu vápenatého v obličkách pre ľudí, ktorí majú tendenciu to robiť.
 Oxalát sodného niektorých potravín môže viesť k tvorbe kameňov v obličkách ľudí s náchylnou predispozíciou k nemu. Autor: Azwer. Zdroj: Pixabay.
Oxalát sodného niektorých potravín môže viesť k tvorbe kameňov v obličkách ľudí s náchylnou predispozíciou k nemu. Autor: Azwer. Zdroj: Pixabay. Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Oxalát sodný. Národné centrum pre biotechnologické informácie. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Chai, w. A Liebman, m. (2005). Vplyv rôznych metód varenia na obsah zeleninového oxalátu. J. Poľnohospodárstvo. Potravinárska chémia. 2005, 53, 3027-3030. Získané z krčiem.ACS.orgán.
- Dagani, r. (Devätnásť deväťdesiat šiestich). CFC ničí Reiona. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Získané z krčiem.ACS.orgán.
- Sajad, m. a Kim, K.Siež. (2016). Extrakcia extracelulárnych polymérnych látok z aktivovaného kalu pomocou oxalátu sodného. Int. J. Prostredie. Sci. Technológia. 13, 1697-1706 (2016). Odkaz obnovený.Prubár.com.
- Jeffrey, G.Do. A parry, g.Siež. (1954). Kryštalická štruktúra oxalátu sodného. J. Hod. Chem. SOC. 1954, 76, 21, 5283-5286. Získané z krčiem.ACS.orgán.
- Okuwaki, a. a kol. (1984). Produkcia oxalátu oxidáciou uhlia s kyslíkom v koncentrovanom roztoku hydroxidu sodného. Indiánsky. Breh. Chem. Plodný. Hovädzie mäso. Deväť. 1984, 23, 648-651. Získané z krčiem.ACS.orgán.
- Hefter, G. a kol. (2018). Rozpustnosť oxalátu sodného v koncentrovaných roztokoch elektrolytov. J Chem & Eng Dáta. 2018, 63, 3, 542-552. Získané z krčiem.ACS.orgán.
- Lak. Jo. (1992). Proces prípravy kyseliny oxalovej a oxalátu vodíka sodného z surového oxalátu sodného. Alebo.Siež. Patent č. 5 171,887. December.15, 1992. Zdroj: FreepatentsSonline.com.
- « Haptes História, funkcie, charakteristiky, odpovede na inmunes
- Štruktúra sodného tripolifosforečnanu (Na5P3O10), vlastnosti, použitia, náraz »

