Nukleofilný nukleofilný útok, typy, príklady, nukleofilita
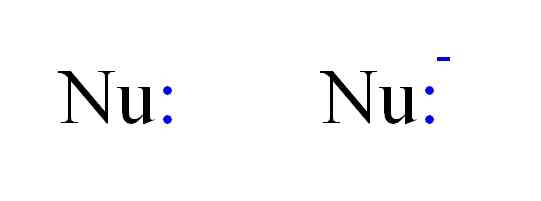
- 1851
- 354
- MUDr. Žigmund Boška
A nukleofilový Je to všetko atóm, ión alebo molekula, ktorý sa snaží darovať páry elektrónov látky s kladným zaťažením alebo regiónmi. Slovo znamená „láska k jadrám“. Ak je atóm alebo molekulárna oblasť zlá v elektronoch, pociťuje silu väčšej príťažlivosti atómovými jadrami; A presne, táto príťažlivosť priťahuje nukleofily.
Preto, ako sa priťahujú opačné príznaky, musia byť nukleofily negatívnymi druhmi; alebo prinajmenšom vlastnenie vysoko negatívnych oblastí v dôsledku lokálnej alebo rozptýlenej koncentrácie elektrónov.
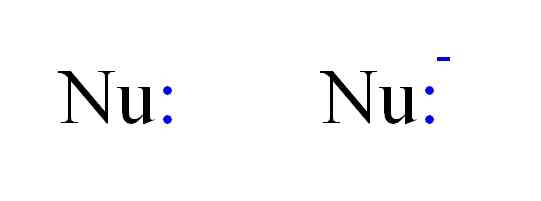 Dva najčastejšie typy nukleofilov v chémii. Zdroj: Gabriel Bolívar.
Dva najčastejšie typy nukleofilov v chémii. Zdroj: Gabriel Bolívar. Takže nukleofil môže byť reprezentovaný písmenami NU, ako na obrázku vyššie. Dvojité body v modrej farbe zodpovedajú niekoľkým elektrónom, ktoré darujú elektrofil; To znamená, že atóm alebo zlá molekula elektrónov. Všimnite si, že nukleofil môže byť neutrálny alebo aniónový, avšak oba dary elektrónových párov.
Útok nukleofilov na elektrofily je základným kameňom nespočetných reakcií a organických mechanizmov. Príkladom nukleofilu je hydroxyl anión, OH-, To sa tiež správa ako základ. Nukleofilita by sa však nikdy nemala zamieňať s základnosťou látky.
[TOC]
Nukleofilný útok
Nukleofily vyzerajú. Nasledujúca chemická rovnica predstavuje nukleofilový útok:
Divoký: + R-LG → R-NU + LG:
Nucleofil Nu: Daruje svoj pár elektrónov A R, ktorý je spojený s elektronegatívnou skupinou LG. Pritom je R-LG Link zlomený, LG's Emigra:, a vytvorí sa nový odkaz R-NU. To je základ pre mnoho organických reakcií.
V nasledujúcej časti bude vidieť, že nukleofil môže byť dokonca aromatickým krúžkom, ktorého elektronická hustota je rozptýlená v jeho strede. Podobne sa nukleofil môže stať Sigma Bond, čo znamená, že elektróny toho istého emigrujú alebo skočia do blízkych jadier.
Môže vám slúžiť: chromát draselného (K2CRO4)Typy nukleofilov
Existuje niekoľko typov nukleofilov, ale obrovský major.
Druh s voľnými elektrónovými pármi
Keď hovoríme o druhoch s voľnými pármi elektrónov, odkazujeme na anióny alebo molekuly s elektronegatívnymi atómami, ako je kyslík, dusík a síra. V časti Príklady budú vidieť veľa nukleofilov tohto typu, okrem aniónu OH- už spomínaný.
Dvojnásobné odkazy
Nukleofil môže mať dvojité väzby, ktoré sú zodpovedné za nukleofilný útok. Musia to však byť dvojité väzby so značnou elektronickou hustotou, takže žiadna molekula, ktorá ich vlastní, sa nebude považovať za silnú nukleofil; to znamená, že nebude mať vysokú nukleofilitu.
Zvážte napríklad benzénový kruh v nasledujúcej reakcii alkylácie (reakcia Friedel-Crafts):
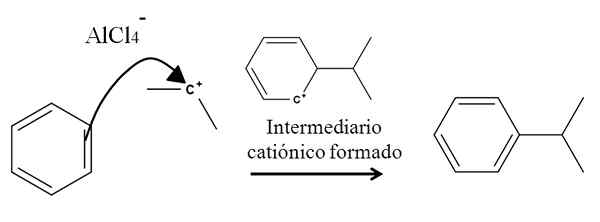 Benzén alkylácia pri aromatickej elektrofilnej substitúcii. Zdroj: Gabriel Bolívar.
Benzén alkylácia pri aromatickej elektrofilnej substitúcii. Zdroj: Gabriel Bolívar. Prítomnosť zmesi ALCL3-(Ch3)2CHCL pochádza z izopropylovej karbony. Jeho pozitívne zaťaženie a nestabilita silne priťahujú elektróny jedného z dvojitých väzieb benzénu, ktoré útočia na karbocation, ako je zastúpená šípkou.
V tomto procese sa vytvorí stručný katión a aromatický medzimadiár, ktorý sa nakoniec transformuje do správneho produktu.
Rovnako ako pri benzéne môžu iné látky s dvojitými väzbami pôsobiť ako nukleofily za predpokladu, že reakčné podmienky sú najvhodnejšie. Podobne musia existovať atómy umiestnené v blízkosti dvojitého spojenia, ktoré darujú elektronickú hustotu, takže „nabíjajú“ elektróny.
Odkazy
Sigma väzby ako také nie sú nukleofily; Ale môže sa správať ako taká, akonáhle sa začne reakcia a začne mechanizmus. Zvážte nasledujúci príklad:
Môže vám slúžiť: Linding Salts: Čo sú, nomenklatúra, vlastnosti, príklady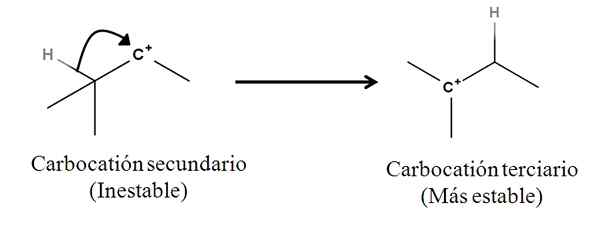 Konverzia sekundárneho na terciárne karbocation migráciou z hydridového aniónu. Zdroj: Gabriel Bolívar.
Konverzia sekundárneho na terciárne karbocation migráciou z hydridového aniónu. Zdroj: Gabriel Bolívar. Bond Sigma C-H susediaci s karbocation sa pohybuje smerom k nemu a správajúc sa ako nukleofil (pozri pohyb zakrivenej šípky). V tomto zmysle je výsledkom, že anión sa pohybuje- do susedného uhlíka, ale tak rýchlo, že sa posudzuje väzba Sigma a jej pár elektrónov ako nukleofilného činidla tohto mechanizmu.
Nukleofilové príklady
V tejto časti sa uvádza niekoľko príkladov prvého typu nukleofilov, ktoré sú v organickej a anorganickej chémii veľmi hojné a dôležité.
Halogenuróz
Halogenuros (f-, Cl-, Br- a ja-) Sú nukleofily. Musia darovať jeden zo štyroch párov valenčných elektrónov. V závislosti od rýchlosti, s akou jeden z týchto halogenuros útočí na elektrofiu, bude mať väčšiu alebo menšiu nukleofilnosť.
Všeobecne platí, že i- Je to lepšie nukleofil ako f- a ďalšie halogenuros, pretože je ľahšie tvoriť kovalentné spojenie, pretože je polarizovateľnejšie; To znamená, objemnejší a s menšou vytrvalosťou vzdať sa svojich elektrónov.
Elektronegatívne molekuly atómu
 Molekuly vody
Molekuly vody Voda, hah, je nukleofil, pretože atóm kyslíka má vysokú negatívnu hustotu a voľné páry elektrónov na darovanie a tvorbu kovalentnej väzby. Alkoholy, ROH, sú tiež nukleofily, z rovnakých dôvodov ako voda.
Malé molekuly dusíka, ako je amoniak, NH3, Majú tiež tendenciu byť nukleofilmi. Je to preto, že dusík môže darovať svoj osamelý pár elektrónov. Podobne amíny, rnh2, Sú to tiež nukleofily.
A okrem malých molekúl s kyslíkom alebo dusíkom sa síry počítajú aj ako nukleofily. Toto je prípad sulfidu vodíka, h2S a Tioles, rsh.
Síra je lepšia nukleofil ako kyslík a dusík, pretože je menej „prilepený“ na svoje elektróny, takže je ľahšie ho darovať. K tejto skutočnosti sa musí tiež pridať, že jeho atóm je objemnejší, to je, polarizovateľný, a preto je schopný tvoriť kovalentné väzby s menšími ťažkosťami.
Môže vám slúžiť: Mohr Metóda: Základy, reakcie, postup, použitieAnióny
Okysličené, dusík, sulfhurizované anióny a vo všeobecnosti niekoľko z nich sú silné nukleofily. Je to preto, že teraz majú negatívne zaťaženie, ktoré ďalej zosilňuje prítomnosť elektrónov, ktoré budú darovať.
Zoberme si napríklad nasledujúce anióny umiestnené v klesajúcom poradí nukleofility:
: Ch3- >: NH2- >: Oh- >: F-
Carboanion Ch3- Je to najsilnejší nukleofil, pretože atóm uhlíka nestabilizuje negatívne zaťaženie, ktorého elektróny sú „zúfalé“ v blízkych jadrách. To sa nestane s AmiDuro, NH2-, ktorého atóm dusíka lepšie stabilizuje negatívne zaťaženie a poskytuje ľahšie pár elektrónov ako OH- alebo f-.
Nukleofilita
Nukleofilita definuje, aký silný je nukleofilný charakter druhu. Závisí to od mnohých faktorov, ale najdôležitejšie sú stérické prekážky počas nukleofilného útoku a pôsobenie rozpúšťadla.
Čím menší je nukleofil, tým rýchlejší a efektívny bude váš elektrofilový útok. Tiež o koľko nižšie interakcie medzi rozpúšťadlom a nukleofilom. Preto podľa toho i- má väčšiu nukleofilitu ako f-.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. (10. vydanie.). Wiley Plus.
- James Ashenhurst. (2020). Tri triedy nukleofilov. Získané z: Masterorganicchemistry.com
- Profesorka Patricia Sheley. (2012). Nukleofily a elektrofily. University of Illinois. Zotavené z: bután.Chem.Priekopa.Edu
- Wikipedia. (2020). Nukleofilový. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (11. februára 2020). Nukleofilová definícia v chémii. Zotavené z: Thoughtco.com
- Rachael Curtis. (5. júna 2019). Nukleofilový. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- « Vlastnosti termodynamického systému, typy, príklady
- Koncept, charakteristiky a príklady rovnomerného rozprávača »

