Štruktúra dusitanu sodného (Nano2), vlastnosti, použitie, riziká

- 4101
- 986
- Blažej Hrmo
On dusitan sodný Je to kryštalická anorganická tuhá látka tvorená sodíkovým iónom+ a dusitanový ión nie2-. Jeho chemický vzorec je nano2. Je to biela kryštalická tuhá látka, ktorá má tendenciu absorbovať vodu z prostredia, to znamená, že je hygroskopická.
V prítomnosti vzduchu pomaly oxiduje dusičnan dusičnan3. Má oxidačné vlastnosti (oxidované iné zlúčeniny) a tiež reduktor (je oxidovaný inými zlúčeninami).
 Dusitan sodný2. Aleksander Sobolewski cez Wikimedia Commons [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons.
Dusitan sodný2. Aleksander Sobolewski cez Wikimedia Commons [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]. Zdroj: Wikimedia Commons. Je prítomný v organizme ľudskej bytosti prirodzene a používa sa ako konzervačný materiál vytvrdeného mäsa a údených rýb, pretože sa vyhýba rastu škodlivých mikroorganizmov.
Má dôležité využitie pri naliehavej liečbe otravy kyanidom, pretože toxický a letálny účinok uvedenej zlúčeniny klesá. Musí sa však podávať s veľkou opatrnosťou a vo všetkých prípadoch nefunguje.
Zistilo sa, že by mohlo zabrániť infekciám očí spôsobených kontamináciou kontaktných šošoviek mikroorganizmami. Niektoré štúdie naznačujú, že ich spotreba s potravinami môže spôsobiť rakovinu, ale odhaduje sa, že sa tomu dá vyhnúť konzumáciou vitamínu C s týmito potravinami.
[TOC]
Štruktúra
Dusičnan sodný je tvorený katiónom sodným+ A anión dusitanu2-.
V dusitanom aninii nie2- Dusík má valenciu +3 a kyslík -2, z tohto dôvodu má anión jediné globálne negatívne zaťaženie.
Anión dusitanu č2- Má uhlovú štruktúru, tj dusíkovú väzbu (N) s atómami kyslíka (O) tvoria uhol uhol.
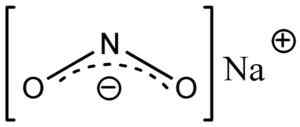 Štruktúra dusitana sodného nano2, kde vidíte uhlovú formu dusitanového aniónu, nie2-. Eschenmoser [verejná doména]. Zdroj: Wikimedia Commons.
Štruktúra dusitana sodného nano2, kde vidíte uhlovú formu dusitanového aniónu, nie2-. Eschenmoser [verejná doména]. Zdroj: Wikimedia Commons. Menovanie
- Dusitan sodný
- Dusitan sodný
- Sodná soľ sodíkovej kyseliny dusná.
Vlastnosti
Fyzický stav
Žltkastá biela kryštalická pevná látka. Ortorrombické kryštály.
Molekulová hmotnosť
68,995 g/mol
Bod topenia
271 ° C
Bod varu
Nevarte. Rozkladá sa nad 320 ° C
Môže vám slúžiť: Hydrid horčík: štruktúra, vlastnosti a použitiaHustota
2,17 g/cm3 pri 20 ° C
Rozpustnosť
Vodné rozpustné: 84,8 g/100 g vody pri 25 ° C. Mierne rozpustný v etanole. Mierne rozpustný v metanolu. Sotva rozpustný v ditel éteru.
pH
Jeho vodné roztoky sú zásadité, pH približne 9. Je to preto, že kyselina dusná je slabá kyselina, ktorá má tendenciu sa disociovať, takže ión nie2- Pokúste sa vziať protón h+ Voda na vytvorenie HNO2, čo vedie k formácii OH ion- Produkujú alkalitu.
Nie2- + H2O → hno2 + Oh-
Ďalšie vlastnosti
Nano dusitan sodný2 V prítomnosti vzduchu pomaly oxiduje dusičnan dusičnan3. Je to hygroskopická tuhá látka, pretože absorbuje vodu z prostredia.
Má oxidačné vlastnosti (môže oxidovať ďalšie zlúčeniny) a tiež reduktory (môže byť oxidovaný inými zlúčeninami).
Ak sa dostanete do kontaktu s materiálmi, ako je drevo, papier alebo textil.
S kyselinami dochádza k rozkladu, ktorý vytvára zmes toxických plynov oxidov dusíka (nieX).
Získanie
Môže sa získať zahrievaním dusičnanu sodného3 S olovom PB:
Starší brat3 + PB → Nano2 + PBO
Prítomnosť v organizme
Anión dusitanu je prirodzene prítomný v krvi a tkanivách, pretože sa tvorí v dôsledku oxidácie non -.
Žiadosti
V potravinárskom priemysle
Používa sa na adafarové mäso, pretože pôsobí ako retenčný agent a ako konzervačný prostriedok, pretože riadi rast mikroorganizmov, čím sa vyhýba najmä rozvoju vývoja Clostridium botulorium Spôsobujúce botulizmus choroby.
Dusičnan sodný v mäse reaguje s hemoglobínom červených krviniek alebo červených krviniek tohto potravy. Používa sa tiež pri liečených údených rybách.
 Údená ryba. Autor: Reinhard Thrainer. Zdroj: Pixabay.
Údená ryba. Autor: Reinhard Thrainer. Zdroj: Pixabay. Ako pohotovostná liečba pri otrave kyanidom
Dusičnan sodný sa používa na liečbu akútnej otravy kyanidom. Je to protijed pre tento vážny problém.
Môže vám slúžiť: acetonitril (C2H3N)Jeho účinok je spôsobený skutočnosťou, že uprednostňuje tvorbu methemoglobínu (typ hemoglobínu) v krvi, ktorá zachytáva kyanidové ióny a neuvoľňuje ich, a tak im bráni uvoľňovať v bunkách, čo ich robí menej toxickými.
V prípade otravy kyanidom sa intravenózne aplikuje dusitan sodný, ktorý trvá asi 12 minút, kým sa vytvorí methemoglobín. Napriek tomuto oneskoreniu ponúka tiež ochranu pre svoj vazodilatačný efekt.
 Intravenózna liečba. Michaelberry v angličtine Wikipedia [CC by 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons.
Intravenózna liečba. Michaelberry v angličtine Wikipedia [CC by 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]. Zdroj: Wikimedia Commons. Pre dilatáciu krvných ciev
Slúži na liečbu pľúcnej arteriálnej hypertenzie, pretože pôsobí oneskorením krvných ciev, čím sa zníži krvný tlak. Odhaduje sa, že tento účinok je spôsobený skutočnosťou, že sa transformuje na oxid dusnatého, ktorý nepôsobí relaxáciu mäkkých svalov.
Príčiny ich účinnosti sú však stále skúmané.
Proti niektorým parazitom
Niektorí vedci zistili, že dusitan sodný inhibuje rast a násobenie črevného parazitu Blastocystis hominis Aj keď je to odolné voči iným liekom.
Zistilo sa, že nano2 Vytvára smrť tohto parazitu apoptózou, ktorá je akýmsi samovraždou parazitových buniek. Dusičnan sodný spôsobuje, že črevné bunky produkujú NO, čo sa zdá byť dôležité v tomto procese.
Aby sa predišlo poškodeniu orgánov
Podľa niektorých štúdií je dusitan silným inhibítorom poškodenia srdca a pečene v procesoch ischémie (znížené zavlažovanie krvi v časti tela). Predpokladá sa, že je to tak preto, že ide o biologickú rezerváciu NO.
Dospelo sa k záveru, že sa dá použiť na zabránenie poškodeniu orgánov po obnovení prietoku krvi, ktorý bol prerušený infarktom, vysokým rizikovým chirurgickým zákrokom alebo transplantácii niektorých orgánov.
Aby sa predišlo infekciám pri používaní kontaktných šošoviek
Zistilo sa, že nano2 bráni tvorbe filmov patogénnych mikroorganizmov Stafylococcus aureus a Pseudomonas aeruginosa O kontaktných šošovkách.
Môže vám slúžiť: Redukcia (chémia) Kontaktné šošovky môžu byť kontaminované baktériami alebo hubami. Fotografovanie kontaktu s objektívmi 7. januára 2006. Zdroj: Fotografie od spoločnosti BPW. Zdroj: Wikimedia Commons.
Kontaktné šošovky môžu byť kontaminované baktériami alebo hubami. Fotografovanie kontaktu s objektívmi 7. januára 2006. Zdroj: Fotografie od spoločnosti BPW. Zdroj: Wikimedia Commons. Na niekoľkých použitiach
Dusičnan sodný sa používa na výrobu sfarbenia, liekov a rôznych organických zlúčenín.
Slúži tiež ako inhibítor korózie vo viacerých tukoch.
Riziká alebo nepríjemnosti
Jedným z problémov s používaním dusitanu sodného na otravy kyanidom je to, že u detí spôsobuje vážne kardiovaskulárne poruchy u detí.
Neodporúča sa pre obete požiaru, kde sa vyskytuje súčasná expozícia kyanidu a oxidu uhoľnatého (CO) (CO). CO znižuje schopnosť krvi transportovať kyslík, takže nano podávanie2 zhoršil by stav malého kyslíka v krvi pacienta.
Vdýchnutý dusitan sodný je dráždivý a toxický, môže poškodiť kardiovaskulárny systém a centrálny nervový systém. Okrem toho je škodlivý pre životné prostredie.
Dusitan sodný požitý jedlom môže byť škodlivý. Dusičnan po dosiahnutí žalúdka reaguje s určitými zlúčeninami tvoriacimi nitrozamínmi, ktoré môžu produkovať rakovinu.
Týmto reakciám sa dá vyhnúť v prítomnosti vitamínu C.
Podľa určitých konzultovaných zdrojov je riziko konzumácie dusitanov vyliečeným mäsom alebo rybami minimálne, pretože dusitan je prirodzene prítomný v slinách.
Zdroje naznačujú, že toto riziko je tiež minimálne v porovnaní s veľkými výhodami konzumácie potravín bez škodlivých mikroorganizmov.
Odkazy
- Bhattacharya, r. a flóra, s.J.Siež. (2015). Toxicita kyanidu a jej liečba. V príručke toxikológie chemických vojnových agentov (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Alebo.Siež. Lekárska knižnica. (2019). Dusitan sodný. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- Kim, D.J. a kol. (2017). Účinnosť antibiofilmu oxidu dusnatého na mäkkej kontaktnej šošovke. BMC Ophthalmol 17, 206 (2017). Získaný z bmcophtalmolu.biomedcentrálny.com.
- Ramis-Ramos, G. (2003). Antioxidanty. Syntetické antioxidanty. V encyklopédii potravinových vied a výživy (druhé vydanie). Zotavené z vedeckých pracovníkov.
- Barozzi Seabra, a. a Durán, n. (2017). Darcovia oxidu dusnatého na liečbu zanedbávaných chorôb. U darcov oxidu dusnatého. Zotavené z vedeckých pracovníkov.com.
- Duranski, m.R. a kol. (2005). Cytoprotektívne účinky dusitanu počas in vivo ischémie-reperfúzie srdca a pečene. J Clin Invest 2005; 115 (5): 1232-1240. NCBI sa zotavila.NLM.NIH.Vláda.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.

