Dusičnan draselný (KNO3)
- 696
- 130
- Gabriel Bahna
Čo je dusičnan draselný?
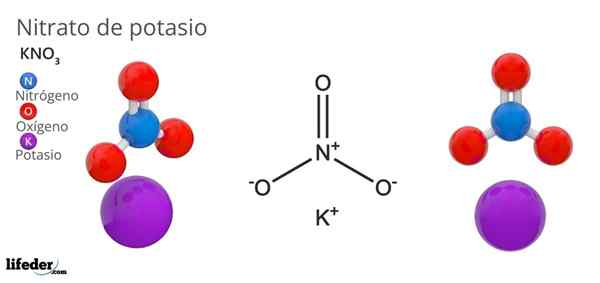
On dusičnan draselný Je to ternárna soľ zložená z draslíka, alkalického kovu a dusičnanu oxoanion. Jeho chemický vzorec je Kno3, Čo znamená, že pre každý K ión+, Neexistuje ión3-- Interakcia s tým. Preto je to iónová soľ a predstavuje jeden z alkalických dusičnanov (lino3, Starší brat3, Rbno3…).
Kno3 Je to silné oxidačné činidlo v dôsledku prítomnosti dusičnanového aniónu. To znamená, že funguje ako rezerva solídnych dusičnanových iónov, na rozdiel od iných vysoko rozpustných solí vo vode alebo veľmi hygroskopický. Mnoho vlastností a použitia tejto zlúčeniny sú spôsobené skôr aniónom dusičnanu, a nie katiónom draslíka.
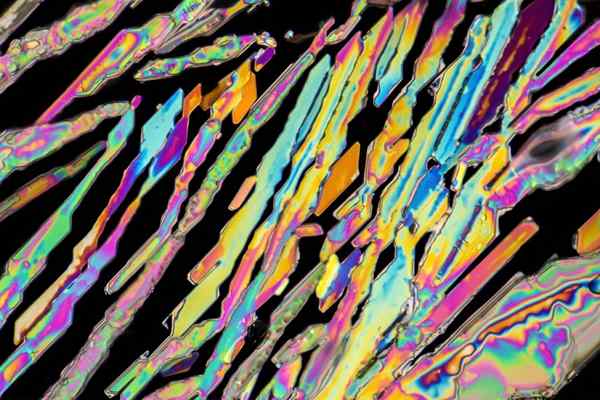 Kryštály dusičnanu draselného
Kryštály dusičnanu draselného Na hornom obrázku sú ilustrované niektoré kryštály KNO3 s tvarmi ihly. Prírodný zdroj Kno3 je soľ, známy ako mená Soľ ani Balón, v angličtine. Tento prvok je známy tiež ako dusičnanový dusičnan alebo nitro minerál.
Nachádza sa vo vyprahnutých alebo púštnych oblastiach, ako aj vo výpadku kavernóznych stien. Ďalší dôležitý zdroj Kno3 Je to guano, exkrement zvierat, ktoré obývajú suché prostredie.
Chemická štruktúra dusičnanu draselného
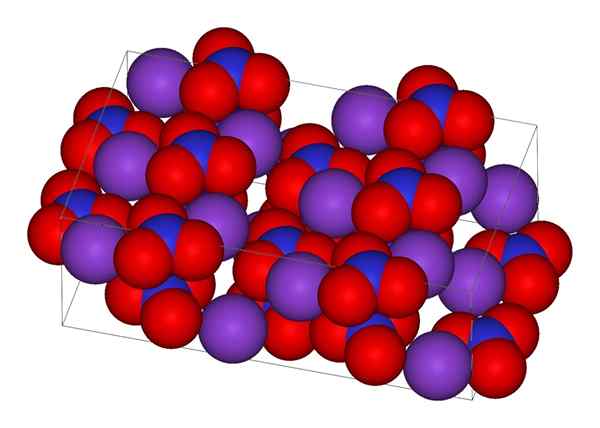 Kryštalická štruktúra dusičnanu draselného
Kryštalická štruktúra dusičnanu draselného Na hornom obrázku je reprezentovaná kryštalická štruktúra KNO3. Fialové gule zodpovedajú K iónom+, zatiaľ čo červená a modrá sú atómy kyslíka a dusíka, respektíve. Kryštalická štruktúra je ortorrombická pri teplote miestnosti.
NION GEOMETRA Č3- Je to trigonálna rovina, s atómami kyslíka vo vrcholoch trojuholníka a atómom dusíka v jeho strede. Predstavuje pozitívnu formálnu záťaž v atóme dusíka a dve negatívne formálne zaťaženie v dvoch atómoch kyslíka (1-2 = (-1)).
Môže vám slúžiť: jednoduchý mikroskopTieto dve negatívne obvinenia z NO3- Presťahujú sa medzi tromi atómami kyslíka a vždy udržiavajú pozitívnu záťaž v dusíku. V dôsledku vyššie uvedených iónov K-+ kryštálu, ktorým sa vyhýbajú, že sú tesne alebo pod dusík aniónov3-.
V skutočnosti obraz ukazuje, ako K ióny+ Sú obklopené atómami kyslíka, červenými guľami. Záverom je, že tieto interakcie sú zodpovedné za kryštalické usporiadanie.
Ostatné kryštalické fázy
Premenné, ako je tlak a teplota3 (Fázy I, II a III). Napríklad fáza II je fáza obrazu, zatiaľ čo fáza I (s trigonálnou kryštalickou štruktúrou) sa tvorí, keď sa kryštály zahrievajú až do 129 ° C.
Fáza III je prechodná tuhá látka, ktorá sa získa z chladenia fázy I a niektoré štúdie ukázali, že vykazuje niektoré dôležité fyzikálne vlastnosti, ako je napríklad ferroelektricita. V tejto fáze kryštál tvorí draslíkové vrstvy a dusičnany, pravdepodobne citlivé na elektrostatické odporu medzi iónmi.
Vo vrstvách fázy III anióny č3- Stratia trochu svojej planárity (mierne krivky trojuholníka), aby sa umožnilo toto usporiadanie, ktoré sa pred akýmkoľvek mechanickým narušením stáva štruktúrou fázy II.
Používanie/aplikácie dusíka draselného
Soľ má veľký význam, pretože sa používa pri mnohých činnostiach človeka, ktoré sa prejavujú v priemysle, poľnohospodárstve, potravinách atď. Tieto použitia zahŕňajú nasledujúce:
- Zachovanie potravín, najmä mäso. Napriek podozreniu, že zasahuje do tvorby nitrosamínu (karcinogénneho činidla), sa stále používa v útočisku.
- Hnojivo, pretože dusičnan draselný poskytuje dva z troch rastlín makronutrient: dusík a draslík. Spolu s fosforom je tento prvok potrebný na vývoj rastlín. To znamená, že je to dôležitá a zvládnuteľná rezerva týchto živín.
- Zrýchne spaľovanie, keď je schopný vyrábať výbuchy, ak je horľavý materiál rozsiahly alebo ak je jemne rozdelený (väčšia plocha povrchu, väčšia reaktivita). Okrem toho je to jedna z hlavných zložiek strelného prachu.
- Uľahčuje odstránenie dotykov vylepšených stromov. Dusičnan dodáva dusík potrebný na to, aby huby zničili drevo pahýlu.
- Zasahuje do redukcie zubnej citlivosti prostredníctvom svojho začlenenia do dentilácií, čo zvyšuje ochranu bolestivých pocitov zuba produkovaného chladom, teplom, kyselinami, sladkostami alebo kontaktom.
- Zasahuje ako hypotenzor v regulácii krvného tlaku u ľudí. Tento účinok by sa podával alebo vzájomne prepojený so zmenou vylučovania sodíka. Odporúčaná dávka v liečbe je 40-80 mEQ/deň draslíka. V tomto ohľade sa zdôrazňuje, že dusičnan draselný by mal diuretický účinok.
Syntéza
Väčšina dusičnanov sa vyrába v baniach púšte v Čile. Môže byť syntetizovaný niekoľkými reakciami:
NH4Nie3 (ac) +koh (ac) => nh3 (Ac) +kno3 (Ac)+h2Alebo (l)
Dusičnan draselný tiež neutralizuje kyselinu dusičného hydroxidom draselným pri vysoko exotermickej reakcii.
KOH (ac) +hno3(conc) => kno3 (Ac) +h2Alebo (l)
V priemyselnom meradle je dusičnan draselný produkovaný dvojitou reakciou na posun.
Starší brat3 (ac) +kcl (ac) => NaCl (ac) +kno3 (Ac)
Hlavným zdrojom KCL je minerál Silvina a nie iné minerály, ako je napríklad karnalit alebo kainit, ktoré sa skladajú aj z iónového horčíka.
Fyzikálne a chemické vlastnosti
Dusičnan draselný v tuhom stave je prezentovaný ako biela alebo vo forme kryštálov ortorombickej štruktúry pri teplote okolitého prostredia a trigonálne pri 129 ° C. Má molekulovú hmotnosť 101 1032 g/mol, je toaleta a má príchuť akra soľného roztoku.
Je to veľmi rozpustná zlúčenina vo vode (316-320 g/liter vody, pri 20 ° C), v dôsledku jej iónovej povahy a ľahkosti molekúl vody na vyriešenie K iónu K+.
Jeho hustota je 2,1 g/cm3 pri 25 ° C. To znamená, že je približne dvakrát hustý ako voda.
Jeho topiace sa body (334 ° C) a varenie (400 ° C) naznačujú iónové väzby medzi k+ a nie3-. Sú však nízke v porovnaní s slaninami iných solí, pretože kryštalická retikulárna energia je nižšia pre monovalentné ióny (to znamená s zaťaženiami ± 1) a tiež nemajú príliš podobné veľkosti.
Môže vám slúžiť: ukazovatele pHRozkladá sa pri teplote blízko bodu varu (400 ° C), aby sa vytvoril draslík a molekulárny kyslík:
Pokaziť sa3(S) => kno2(s) + alebo2g)
Odkazy
- Publikácia. (2018). Dusičnan draselný. Obnovený z pubchem.Ncbi.NLM.Nikto.Vláda
- Krištáľový akt. (2009). Rast a monokryštálové vylepšenie dusičnanu draselného draselného, KNO3. B65, 659-663.
- Marni Wolfe. (3. októbra 2017). Riziká dusičnanu draselného. Livestrong sa zotavil.com
- Ametyst Galleries, Inc. (1995-2014). Minerál. Galérie sa zotavili.com