Myoglobín

- 3965
- 833
- Alfréd Blaho
 Štruktúra myoglobínu
Štruktúra myoglobínu Čo je myoglobín?
Ten Myoglobín Je to intracelulárny globulárny proteín nachádzajúci sa v cytosóle kostrových a srdcových svalových buniek. Jeho základnou funkciou je tvoriť rezervu kyslíka a uprednostňovať intracelulárny transport kyslíka.
John Kendrew a Max Perutz získali Nobelovu cenu za chémiu v roku 1962 za štúdium na guľkových proteínoch. Títo autori objasňujú trojrozmernú štruktúru myoglobínu a hemoglobínu. Historicky myoglobín bol jedným z prvých proteínov, ktorého bola stanovená trojrozmerná štruktúra.
Globulárne proteíny sú kompaktné molekuly s sférickým tvarom; Sú rozpustné v cytosóle alebo v lipidovej časti bunkových membrán. Sú zodpovední za hlavné biologické účinky, na rozdiel od vláknitých proteínov, ktorých hlavné funkcie sú štrukturálne.
Myoglobin dáva čerstvé mäso červené. Toto sa vyskytuje, keď je myoglobín okysličený ako oximiglobín a železo, ktoré ho tvorí v železnici: MB-FE2+O2.
Keď je mäso vystavené životnému prostrediu, železitý, nestabilný, oxidovaný a stáva sa železitý a za týchto podmienok sa farba hnedých tónov pre tvorbu metamioglobínu (MB-FE3 + + O2 ●-).
Normálne sú hladiny myglobínu v krvi veľmi malé, sú rádovo mikrogramy na liter (μg/l). Tieto hladiny sa zvyšujú, keď dôjde k deštrukcii svalov ako pri rabdomyolýze kostrového svalu alebo v prípade srdcového infarktu s deštrukciou tkaniva a v niektorých myopatiách.
Jeho prítomnosť v moči sa pozoruje za určitých podmienok, v ktorých je poškodenie tkaniva veľmi dôležité. Jeho včasná diagnostická hodnota pre srdcový infarkt je diskutabilná.
Môže vám slúžiť: Celkové jadroŠtruktúra myoglobínu
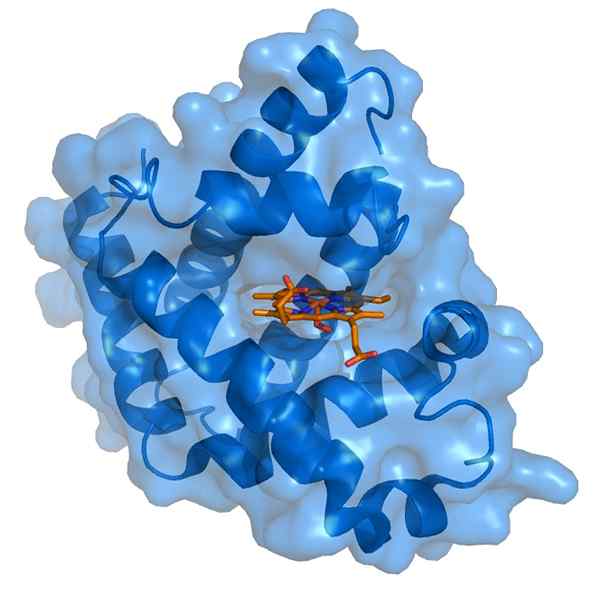 Myoglobín a jeho protetická skupina hemo (Zdroj: Thomas Spletttsser/CC By-S (https: // creativecommons.Org/licencie/By-SA/3.0) Via Wikimedia Commons)
Myoglobín a jeho protetická skupina hemo (Zdroj: Thomas Spletttsser/CC By-S (https: // creativecommons.Org/licencie/By-SA/3.0) Via Wikimedia Commons) Myoglobín má molekulovú hmotnosť takmer 18 kDa vrátane skupiny Hemo Group. Skladá sa zo štyroch špirálových segmentov zjednotených „náhlymi zákrutami“. Tieto vrtule na myoglobínu sú úzko zabalené a udržiavajú svoju štrukturálnu integritu, aj keď je skupina Hemo odstránená.
Štruktúra globulárnych proteínov, ako aj všetky bunkové proteíny, je hierarchická, takže štruktúra myoglobínu je tiež. Prvá úroveň je primárna štruktúra tvorená lineárnou sekvenciou aminokyselín a myoglobínu sa skladá z 153 aminokyselinových reťazcov.
Sekundárna štruktúra myoglobínu spočíva v tvorbe vrtule Alpha. Myoglobín obsahuje 8 vrtule Alpha vytvorených opakovanými polypeptidovými časťami, ktoré sa viažu na krátke segmenty aperiadického riadenia.
Terciárna štruktúra pozostáva z trojrozmernej konformácie s biologickou aktivitou. Najdôležitejšími charakteristikami tejto štruktúry je skladanie. Kvartérna štruktúra sa vzťahuje na zostavenie dvoch alebo viacerých samostatných a zjednotených polypeptidových reťazcov prostredníctvom ne -kovalentných väzieb alebo interakcií.
Myoglobín má veľmi kompaktnú štruktúru, s hydrofóbnym odpadom nasmerovaným na vnútorný a hydrofilný alebo polárny zvyšky smerované smerom von. Vnútorný apolárny odpad sa tvorí leucínom, valínom, metódou a fenylalanínom. Jediným vnútorným polárnym odpadom sú dva histidíny, ktoré majú funkcie v aktívnom centre.
Protetická skupina hemo sa nachádza v rozštiepení apolárnej vnútornej časti polyloglobínového polypeptidového reťazca. Táto skupina obsahuje železo vo forme železa železa, ktoré sa viaže na kyslík za vzniku oximioglobínu.
Môže vám slúžiť: GLUT4: Charakteristiky, štruktúra, funkcieFunkcia myoglobínu
Funkciou myoglobínu je zjednotiť kyslík do hemo skupiny jeho štruktúry a tvoriť kyslíkovú rezervu na funkciu svalov. Pokiaľ je kyslík zachytený v štruktúre myoglobínu v cytoplazme svalovej bunky, jeho intracelulárny tlak, stanovený voľným kyslíkom, zostáva nízky.
Nízky intracelulárny tlak kyslíka udržiava gradient pre vstup kyslíka do bunky. To uprednostňuje prechod kyslíka z obehového torrentu do svalovej bunky. Keď myoglobín nasýti intracelulárny kyslík, zvyšuje sa, čo postupne znižuje gradient, a tak znižuje prenos.
Krivka väzby kyslíka na myoglobín je hyperbolická. V počiatočných častiach krivky malé zmeny v čiastočnom tlaku kyslíka spôsobujú veľké zmeny v saturácii myoglobínu s kyslíkom.
Potom, do tej miery, že čiastočný tlak kyslíka zvyšuje saturácia, sa naďalej zvyšuje, ale pomalšie, to znamená, že na zvýšenie saturácie myoglobínu je potrebný oveľa väčší zvýšenie tlaku čiastočného kyslíka a progresívne sa krivka vyrovnáva.
Existuje premenná, ktorá meria afinitu krivky nazývanú p50, čo predstavuje čiastočný tlak kyslíka potrebný na nasýtenie myoglobínu obsiahnutého v roztoku o 50%. Takže, ak sa P50 zvýši, hovorí sa, že myoglobín má menšiu afinitu a ak P50 klesá, hovorí sa, že myoglobín má väčšiu afinitu k kyslíku.
Môže vám slúžiť: PROERITROBLAST: Charakteristiky, morfológia, regulácia, farbenieKeď sa skúmajú krivky väzby kyslíka s myoglobínom a hemoglobínom, je pozorované, že pri akomkoľvek čiastočnom tlaku kyslíka je myoglobín skôr nasýtený ako hemoglobín, čo naznačuje, že myoglobín má väčšiu afinitu k kyslíku ako kyslík ako kyslík ako hemoglobín.
Typy svalových vlákien a myoglobínu
Skeletálne svaly majú vo svojom zložení rôzne typy svalových vlákien, niektoré pomalé kontrakcie a iné rýchle kontrakcie. Rýchle kontrakčné vlákna sú štrukturálne a metabolicky prispôsobené na rýchle a rázne a rázne a anaeróbnym spôsobom.
Vlákna s pomalými kontrakciami sú prispôsobené na nízku rýchlosť, ale predĺženejšie kontrakcie, typické pre cvičenia aeróbneho odporu. Jedným zo štrukturálnych rozdielov týchto vlákien je koncentrácia myoglobínu, ktorá im dáva meno bielych a červených vlákien.
Červené vlákna majú vysoký obsah myoglobínu, ktorý im dáva červenú farbu, ale tiež im umožňuje udržiavať veľké množstvo kyslíka, čo je nevyhnutné pre ich funkciu.
Normálne hodnoty
Normálne hodnoty krvi u mužov sú od 19 do 92 µg/l a u žien od 12 do 76 µg/l, existujú však rozdiely v hodnotách v rôznych laboratóriách.
Tieto hodnoty sa zvyšujú, keď dôjde k deštrukcii svalov ako pri rabdomolýze kostrového svalu, pri rozsiahlych popáleninách, elektrických otrasoch alebo rozsiahlej svalovej nekróze v dôsledku oklúzie arteriálnej, v infarkte myokardu a v niektorých myopatiách.
Za týchto podmienok sa myoglobín objavuje v moči a dáva mu charakteristickú farbu.

