Tunsen Munder Charakteristiky, funkcie, príklady použitia

- 4788
- 1136
- Alfréd Blaho
On Bunsen zapaľovač Je to laboratórny prístroj, ktorý je schopný efektívne a bezpečne dodávať zdroj tepla, ktorý je produktom spaľovania plynu, ktorý je zvyčajne metán alebo zmes propánu a butánu. Samotný tento nástroj je synonymom vedy a chémie.
Jeho meno je spôsobené nemeckým chemikom Robertom Bunsenom, ktorý bol zodpovedný spolu s trénerom Peterom Desom za jeho implementáciu a zlepšenie založené na modeli, ktorý už navrhol Michael Faraday. Tento zapaľovač je malý a ľahký, takže sa dá prakticky presunúť na akékoľvek miesto, kde je fľaša na plyn a optimálne spojenia.
 Bunsen ľahšie zahrievanie roztoku banky. Zdroj: Sally V/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0)
Bunsen ľahšie zahrievanie roztoku banky. Zdroj: Sally V/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/4.0) Tunsen zapaľovač je uvedený v akcii. Všimnite si, že scenár nie je ani laboratória. Plameň, modrý, zahrieva obsah banky, aby sa vyvinula chemická reakcia, alebo jednoducho rozpustenie tuhej rýchlejšie. Hlavným použitím tohto prístroja je preto jednoduché zahrievanie povrchu, vzorky alebo materiálu.
Zapaľovač Bunsen sa však používa aj pre širokú škálu metód a procesov, ako je napríklad štúdia plameňa, sterilizácia, destilácia, spaľovanie a rozklad. Od stredoškolského vzdelávania je príčinou prekvapenia a obáv medzi študentmi, aby sa neskôr stal bežným nástrojom.
[TOC]
História
Pôvod tohto ikonického ľahšieho pochádzajú z roku 1854 v jednom z laboratórií University of Heidelberg, kde pracoval Robert Bunsen. Dovtedy mali univerzitné zariadenia už základný plynový a ľahší rúrkový systém, s ktorým vykonávali experimenty.
Avšak títo zapaľovače, ktoré navrhol Michael Faraday, generovali veľmi jasné a „špinavé“ plamene, čo znamená, že sa uložili na povrch, ktorý hral uhlie. Tieto plamene, okrem maskovania farieb, ktoré oslobodili určité látky, keď boli zahriate, neboli dosť horúce.
Robert Bunsen sa teda spolu s nemeckým trénerom Peterom Dragom rozhodol implementovať vylepšenia v lastvoch Faraday. Na dosiahnutie tohto cieľa hľadali, aby plyn spálený vyšším prietokom vzduchu, vyšší ako ten, ktorý bol voľne okolo laboratória. Týmto spôsobom sa narodil zapaľovač Bunsen-Disaga.
Odvtedy mali laboratóriá po ruke zapaľovač, ktorý vám umožňuje získať oveľa horúcu a „čistú“ plameň. Vďaka tomuto zapaľovaču boli založené základy alebo pôvod spektroskopie.
Môže vám slúžiť: karbonoidy: prvky, vlastnosti a použitiaCharakteristiky a časti Tunsenu zapaľovač
- Prístroj
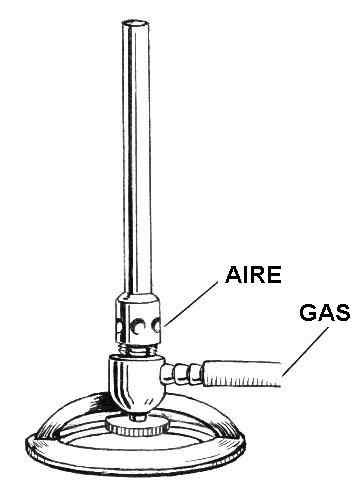 Kreslenie častí Bunsena zapaľovača. Zdroj: Pearson Scott Foresman / Public Domain
Kreslenie častí Bunsena zapaľovača. Zdroj: Pearson Scott Foresman / Public Domain Na vynikajúcom obrázku máte ilustráciu zapaľovača Tunsen. Príslušné záznamy sú uvedené pre vzduch aj plyn.
Plyn prechádza vo vnútri gumovej hadice od plynového kohútika, ktorý sa nachádza v rovnakom laboratórnom hostinci, po ľahší vchod. V dolnej oblasti zapaľovača, tesne nad podperou kruhu, sa nachádza ventil alebo koleso, ktoré vyrovnáva prietok plynu, ktorý bude mimo dýzy zapaľovača.
Vzduch na druhej strane vstupuje do zapaľovania cez kruhové (alebo obdĺžnikové) otvory jeho náhrdelníka. Keď je náhrdelník rozbitý, vo vnútri otvorov prúdí viac vzduchu a mieša sa s plynom. Táto zmes vzduchového plynu sa zvýši pozdĺž hlavne alebo stĺpca, aby sa konečne vyskytla cez dýzu zapaľovača.
Celý ľahší ako celok je vyrobený z ľahkého kovu, napríklad z hliníka, a jeho veľkosť je dostatočne malá na to, aby sa mohla uložiť na akúkoľvek poličku alebo zásuvku.
- Hovory
Reduktor
 Plameň získaný zapaľovačom Bunsen sa môže líšiť v závislosti od množstva prichádzajúceho vzduchu. Zdroj: Arthur Jankowski/CC By-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/)
Plameň získaný zapaľovačom Bunsen sa môže líšiť v závislosti od množstva prichádzajúceho vzduchu. Zdroj: Arthur Jankowski/CC By-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/) Keď je zdroj tepla umiestnený práve na výške dýzy zapaľovača, či už s použitím osvetlenej alebo iskry, zmes vzduchového plynu sa bude horieť a spaľuje sa spaľovanie. Objaví sa potom plameň. Vizuálne a chemické charakteristiky tohto plameňa však závisia od pomeru AIRE-GAS.
Ak je náhrdelník zatvorený a zabráni vzduchom medzi otvormi, bude tu zmes bohatá na plyn, ktorá bude horieť kyslíkom z okolitého vzduchu. Tento plameň zodpovedá 1 (vynikajúci obraz) a je známy ako plameň „bezpečný“ a „špinavý“, pretože je najmenej horúci a ten, ktorý tiež vytvára najväčšie množstvo sadzí. Všimnite si, aký je jasný a tiež jej žlto oranžové farby.
Luminozita tohto plameňa je spôsobená skutočnosťou, že častice sadzí, prakticky zložené z atómov uhlíka, absorbujú teplo a požiarne svetlo a farbu a farbu a farbu. Čím viac je otvorený vchod plynu, tým väčší bude tento plameň.
Tento plameň je tiež známy tým, že je reduktorom, pretože poskytuje uhlík ako častice sadov, ktoré sú schopné redukovať niektoré látky.
Oxidata
Keď sa náhrdelník otáča, otvory, cez ktoré sa otvorí vzduch, sa zvyšuje množstvo vzduchu vo výslednej plynnej zmesi. Výsledkom je, že žltý plameň sa stane čoraz modrejším (od 2 do 4) do bodu, keď sa môže zdať priehľadné, ak pozadie a čistota zmesi umožní.
Môže vám slúžiť: tepelná: štruktúra, charakteristiky, formovanie, príkladyFlame 4 je najžiadanejší a najužitočnejší v laboratóriu, pretože je najteplejší a môže tiež dokonale oxidovať vzorku, ktorá je umiestnená do vášho kontaktu. Z tohto dôvodu je tento plameň známy tým, že je oxidačný, pretože produkty spaľovania (v oxidu uhličitého a vodnej pary) nezasahujú do okolitého kyslíka a látky na oxidáciu.
Funkcie/použitia
 Zapaľovač osvetlenia Tunsen
Zapaľovač osvetlenia Tunsen Z predchádzajúcej časti je možné vyvodiť záver, že plameň je najdôležitejším prvkom alebo charakteristikou zapaľovača Bunsen. V skutočnosti je to, že definuje príslušné funkcie alebo použitie tohto nástroja, ktoré v skratke nie sú ničím iným ako na zahriatie povrchu, materiálu alebo vzorky.
To však neznamená, že sa dá použiť na zahrievanie všetkého v laboratóriu. Na začiatok, bod topenia materiálu musí byť nad 1500 ° C, maximálna teplota, ku ktorej môže plameň dosiahnuť. Inak by to roztopilo a spôsobilo katastrofu v pracovnom hostinci.
Po druhé, teplota plameňa je taká vysoká, že je schopná nastaviť výpary akéhokoľvek organického rozpúšťadla, čo by zvýšilo riziko ohňa. Preto by sa mali zahriať iba kvapaliny s vysokými bodmi varu a nízkou volatilitou.
Z tohto dôvodu je voda príkladom ideálnej tekutiny na zahrievanie pomocou Bunsena zapaľovača. Napríklad je zvyčajne časté na zahrievanie destilačných loptičiek, zrážajúcich sa nádob.
Použite príklady
Spaľovanie
Jedným z hlavných použití zapaľovača Bunsen je predložiť vzorku spaľovania; to znamená, že ho rýchlo a exotermická oxidujte. Na tento účel sa používa oxidačný plameň (modrý a takmer priehľadný) a vzorka sa umiestni vo vnútri nádoby, ako je topenie.
Väčšina vzoriek sa však následne presunie na MUFLA, kde môžete pokračovať v kúrenovaní celé hodiny (dokonca aj celý deň).
Tepelný rozklad
Rovnako ako pri spaľovaní, používanie zapaľovača Bunsen. Táto metóda však neumožňuje jeho monitorovanie pokrokom rozkladu, keď nastane čas.
Môže vám slúžiť: dimetylanylín: štruktúra, vlastnosti, syntéza, použitieSkúška
Kovové ióny sa dajú kvalitatívne zistiť testovaním plameňa. Za týmto účelom je do kontaktu so vzorkou do kontaktu s predchádzajúcim zahrievaným a ponoreným drôtom v kyseline chlorovodíkovej a odoberie sa vo vnútri plameňa.
Odpojené farby pomáhajú identifikovať prítomnosť kovov, ako je meď (modrú zelená), draslík (fialová), sodík (intenzívna žltá), vápnik (oranžová červená) atď.
Sterilizácia materiálov
Flame Heat je taká, že sa dá použiť na ďalšie dômyselné použitie: na zničenie mikroorganizmov na povrchu materiálov. Je to užitočné najmä pri riešení skla alebo kovov, ktoré sú určené na účely úzko spojené so zdravím (ihly, pipety, pokožky hlavy atď.).
Destilácia
Predtým sa hovorilo, že voda je jednou z tekutín, ktoré sa výhodne zahrievajú zapaľovačom Tunsen. Z tohto dôvodu sa používa na zahrievanie destilačných guličiek, a tak variť vodu tak, aby jej výpary ťahali niektoré esencie alebo vône rastlinných látok (pomarančové šupky, škoricový prach atď.).
Na druhej strane sa môže použiť aj na destiláciu iných typov zmesí za predpokladu, že intenzita plameňa je moderovaná a v procese sa generuje príliš veľa výparov.
Stanovenie bodov varu
S pomocou trubice Thiele, oleja, opory a kapitoly. Tento experiment je celkom bežný vo výučbových laboratóriách všeobecnej chémie a organickej chémie.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2020). Horák Bunsen. Zdroj: In.Wikipedia.orgán
- Úrok. (31. marca 2016). História chémie: Deň horáka Bunsen. Získané z: zlúčeniny.com
- Nikki Wyman. (31. augusta 2015). Bunsen Burner: Časti, funkcia a diagram. Získané z: štúdie.com
- Nichols Lisa. (18. augusta 2019). Bunsen Burners. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Wayne State University. (s.F.). Správne použitie horáka Bunsen. [PDF]. Získané z: výskumu.Wayne.Edu

