Lysínske charakteristiky, štruktúra, funkcie, biosyntéza
- 3060
- 910
- Alfréd Blaho
Ten lyzín (Škriatok, Klimatizovať) alebo kyselina ε-diaminoproová, Je to jedna z 22 aminokyselín, ktoré vyrábajú.
Drechsel ho objavil v roku 1889 ako produkt hydrolýzy (rozklad) kazeinogénu. O niekoľko rokov neskôr Fischer, Siegfried a Hedin zistili, že je tiež súčasťou proteínov, ako je želatína, vaječný albumín, konglutín, fibrín a ďalšie proteíny.
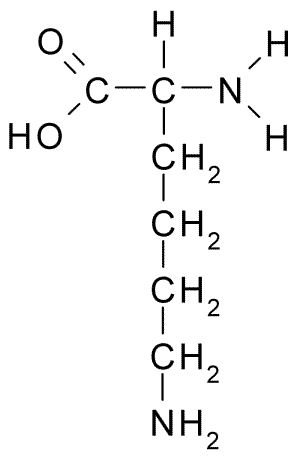
 Chemická štruktúra aminokyselinového lyzínu (zdroj: borb, cez Wikimedia Commons)
Chemická štruktúra aminokyselinového lyzínu (zdroj: borb, cez Wikimedia Commons) Jeho výskyt sa potom demonštroval v sadeniciach semien v klíčení a vo väčšine skúmaných rastlinných proteínov, ktoré určili ich hojnosť ako všeobecný základný prvok všetkých bunkových proteínov.
Považuje sa za jednu z hlavných „obmedzujúcich“ aminokyselín v diéte bohatých na obilniny a z tohto dôvodu sa predpokladá, že kvalita obsahu bielkovín konzumovaných rôznymi nedostatočne rozvinutými populáciami sveta je ovplyvnená.
Niektoré štúdie určili, že príjem lyzínu uprednostňuje produkciu a uvoľňovanie hormónov inzulínu a glukagónu, čo má dôležitý vplyv na energetický metabolizmus tela.
[TOC]
Charakteristika
Lyzín je pozitívne načítaná a-aminokyselina.53, čo naznačuje, že fyziologická pH, vaša substituentná aminoskupina je úplne ionizovaná, pričom k aminokyselinám poskytuje pozitívne čisté zaťaženie aminokyselinami.
Jeho výskyt v proteínoch rôznych typov živých organizmov je blízko 6% a rôzni autori sa domnievajú, že lyzín je nevyhnutný pre správny rast a opravu tkanív tkanív.
Bunky majú veľa derivátov lyzínu, ktoré plnia veľkú rozmanitosť fyziologických funkcií. V nich sú hydroxilisín, metyl-lyzín a ďalšie.
Je to ketogénna aminokyselina, ktorá naznačuje, že jej metabolizmus produkuje uhličité kostry sprostredkovaných substrátov pre molekuly tvorby trás, ako je acetyl-CoA, s následnou tvorbou ketónových telies v pečeni.
Na rozdiel od iných esenciálnych aminokyselín, nejde o glykogénnu aminokyselinu. Inými slovami, jeho degradácia nekončí výrobou sprostredkovateľov trás, ktoré produkujú glukózu.
Štruktúra
Lysín je klasifikovaný v skupine základných aminokyselín, ktorých postranné reťazce majú ionizovateľné skupiny s pozitívnym zaťažením.
Jeho bočný reťazec alebo skupina R R má druhú primárnu aminoskupinu pripevnenú k atómu uhlíka v polohe jeho alifatického reťazca, a preto je názov „ε-aminokaproico“.
Má atóm A uhlíka, ku ktorému sa spojí atóm vodíka, aminoskupina, karboxylová skupina a R.
Pretože laterálny reťazec má tri metylénové skupiny, a hoci molekula lyzínu má aminoskupinu s pozitívnym nábojom na fyziologické pH, táto skupina R má silný hydrofóbny charakter, takže je často „zakopaný“ v proteínových štruktúrach, pričom zostane iba ε- aminoskupina.
Aminoskupina bočného reťazca lyzínu je vysoko reaktívna a zvyčajne sa zúčastňuje aktívnych centier mnohých proteínov s enzymatickou aktivitou.
Funkcia
Lyzín, ktorý je esenciálnym aminokyselinou, plní viac funkcií, ako je mikroživiny, najmä u ľudí a iných zvierat, ale je tiež metabolit v rôznych organizmoch, ako sú baktérie, kvasinky, rastliny a riasy.
Charakteristiky jeho postranného reťazca, konkrétne charakteristík skupiny ε-amino pripevnenej k uhľovodíkovému reťazcu, ktorý je schopný tvoriť vodíkové mosty, dodávajú mu špeciálne vlastnosti, ktoré ho spôsobujú, že sa zúčastňujú na katalytických reakciách v rôznych typoch enzýmov.
Môže vám slúžiť: Flora a fauna zacatecas: Reprezentatívne druhyJe to veľmi dôležité pre normálny rast a prestavbu svalov. Okrem toho je to prekurzorová molekula pre karnitín, zlúčenina syntetizovaná v pečeni, mozgu a obličkách, ktoré sú zodpovedné za transport mastných kyselín do mitochondrií na výrobu energie.
Táto aminokyselina je tiež potrebná na syntézu a tvorbu kolagénu, dôležitý proteín systému spojivového tkaniva v ľudskom tele, takže prispieva k udržiavaniu štruktúry kože a kostí.
Experimentálne rozpoznáva funkcie v:
- Ochrana čriev pred stresovými stimulmi, kontamináciou bakteriálnymi a vírusovými patogénmi atď.
- Znížte príznaky chronickej úzkosti
- Uprednostňuje rast dojčiat, ktoré rastú v diéte nízkej kvality
Biosyntéza
Ľudské bytosti a iné cicavce nemôžu syntetizovať aminokyselinový lyzín In vivo A z tohto dôvodu ho musia získať zo zvierat a rastlinných bielkovín požitých potravinami.
V prírodnom svete sa pre biosyntézu lyzínu vyvinuli dve rôzne trasy: jedna, ktorá používa baktérie, rastliny a huby „nižšie“ a druhá používaná euglénidmi a „vynikajúcimi“ hubami.
Biosyntéza lyzínu v rastlinách, nižšie huby a baktérie
V týchto organizmoch sa lyzín získava z kyseliny diamineopimelovej cez 7 -stupňovú cestu, ktorá začína pyruvátmi a semi -etickým aspartátom. Napríklad v prípade baktérií táto trasa znamená produkciu lyzínu s účelmi (1) syntézy proteínov, (2) syntéza diaminopimelátu a syntéza (3) lyzínu, ktorý sa použije v bunkovej stene Pepidoglin.
Aspartát v organizmoch, ktoré prezentujú túto cestu, vedie k Lisine, ale tiež sa odvodzuje pri výrobe metionínu a treonínu.
Diverge trasa v Semiiard ASP.
Biosyntéza lyzínu v húb Superior a Euglénidos
Syntéza lyzínu novo V vynikajúcich hubách a euglénidových mikroorganizmoch sa vyskytuje prostredníctvom sprostredkovateľa L-a-aminoadipato, ktorý sa mnohokrát transformuje rôznymi spôsobmi, ktoré sa konajú v baktériách a rastlinách.
Trasa pozostáva z 8 enzymatických krokov, ktoré zahŕňajú 7 bezplatných sprostredkovateľov. Prvá polovica trasy sa odohráva v mitochondriách a dosahuje syntézu a-aminoadipato. Konverzia a-aminoadipato v L-lizíne sa vyskytuje neskôr v cytosóle.
- Prvý krok trasy pozostáva z kondenzácie molekúl a-ketoglutarátu a acetyl-CoA enzýmom homochitrátovou syntázou, ktorá poskytuje kyselinu homocitrónovú.
- Kyselina homocitrová sa dehydratuje v kyseline Cis-homoakonitický, ktorý sa potom premieňa na kyselinu homoizocitrónovú pomocou enzýmu homoakonitasa.
- Kyselina homoizokitrónová sa oxiduje homoizocytrátovou dehydrogenázou, ktorá dosahuje prechodnú tvorbu oxyglutarátu, ktorá stráca molekulu oxidu uhličitého (CO2) a končí ako a-katoadripová kyselina kyselina.
- Táto posledná zlúčenina je transaminovaná procesom závislým od glutamátu vďaka pôsobeniu aminotransferázy aminoadipového enzýmu, ktorý produkuje kyselinu L-a-aminoadipovú kyselinu.
- Bočný reťazec kyseliny L-a-aminoadipovej sa redukuje za vzniku L-a-aminoadipic-A-semi-assess.
- Sacoopín reduktáza potom katalyz. Následne je imino redukovaný a získa sa Sacoopín.
- Nakoniec je väzba uhlíkového dusíka v časti glutamát sakaopínu „rezaná“ enzýmom sakraopín dehydrogenázy, ktorá sa vzdáva ako konečné produkty L-lisin a a-zeglutararate kyselina kyselina.
Alternatívy k lyzínu
Experimentálne testy a analýza vykonávané s potkanmi v období rastu umožnili objasniť, že ε-N-Acetyl-lyzín môže nahradiť lyzínu na podporu rastu mladých, a to vďaka prítomnosti enzýmu: ε-lizín aciláza.
Môže vám slúžiť: Afotická zóna: Charakteristiky, flóra, faunaTento enzým katalyzuje hydrolýzu ε-N-acetyl-lyzín na výrobu lyzínu a robí tak rýchlo a v hojných množstvách.
Degradácia
U všetkých druhov cicavcov je prvý krok v degradácii lyzínu katalyzovaný lyzín-2-oxoglutarátovým enzýmom reduktázy, schopný premieňať lyzínu a a-oxoglutarát na sacalopín, aminokyselinový derivát prítomný vo fyzikálnych tekutinách zvierat a existencia v nich bola preukázaná koncom 60. rokov.
Sakroopín je späť k a-aminoadipato ô-semimálnedehidu a glutamátu pôsobením enzýmu sacaropínovej dehydrogenázy. Ďalší enzým je tiež schopný používať Sacaropina ako substrát na hydrolyz.
Sacaropín, jeden z hlavných metabolických sprostredkovateľov v degradácii lyzínu, má mieru náhrady vo fyziologických podmienkach, extrémne vysoký, takže sa nezhromažďuje v tekutinách alebo tkanivách, ktoré boli preukázané vysokými aktivitami zistenými vývojárom dehydrogenázy.
Kvantita a aktivita enzýmov zapojených do metabolizmu lyzínu však vo veľkej miere závisí od rôznych genetických aspektov každého konkrétneho druhu, pretože existujú vnútorné variácie a špecifické kontrolné alebo regulačné mechanizmy.
„Sacaropinúria“
Existuje patologický stav súvisiaci s veľkou stratou aminokyselín, ako je lyzín, citrulín a histidín močom, a to je známe ako „saropinúria“. Sacaropín je derivát aminokyselín metabolizmu lyzínu, ktorý sa vylučuje spolu s tromi aminokyselinami uvedenými v moči „saropinurických“ pacientov.
Sacaropín bol pôvodne objavený v pivných kvasinkách a je predchodcom lyzínu v týchto mikroorganizmoch. V iných eukaryotických organizmoch sa táto zlúčenina vyrába počas degradácie lyzínu v mitochondriách hepatocytov
Potraviny bohaté na lyzínu
Lysín sa získava z potravín konzumovanej stravou a priemerná dospelá ľudská bytosť potrebuje najmenej 0.8 g tohto dňa. Nachádza sa v mnohých proteínoch živočíšneho pôvodu, najmä v červenom mäse, ako sú kravy, jahňacie a kuracie mäso.
Je to v rybách, ako je tuniak a losos a v ovocných ovociach, ako sú ustrice, krevety a mušle. Je tiež prítomný v zložkových proteínoch mliečnych výrobkov a ich derivátov.
V rastlinných potravinách sa nachádza v zemiakoch, v paprike a v póroch. Je tiež v avokádos, broskyne a hrušky. V strukovinách, ako sú fazule Arriñonados, cícer a sója; v tekvicových semenách, v orechoch makadamie a v Anacardos (Merey, Marañón atď.).
Výhody vášho príjmu
Táto aminokyselina je zahrnutá v mnohých liekoch na výživovú formuláciu, tj izolovaných z prírodných zlúčenín, najmä z rastlín.
Používa sa ako antikonvulzívny a jeho účinnosť sa preukázala aj pri inhibícii replikácie Vírus herpes simplex Typ 1 (HSV-1), ktorý sa zvyčajne prejavuje vo chvíľach stresu, keď je imunitný systém depresívny alebo „oslabený“ ako ampulky alebo herpes na perách.
Účinnosť doplnkov L-Lisín na liečbu herpes pier je spôsobená skutočnosťou, že to „konkuruje“ alebo „blokuje“ arginín, inú proteínovú aminokyselinu, ktorá je potrebná na násobenie HSV-1.
Zistilo sa, že lyzín má tiež antianoolitické účinky, pretože pomáha blokovať receptory, ktoré sa podieľajú na reakciách na rôzne stresové stimuly, okrem účasti na znížení hladín kortizolu, „stresovým hormónom“.
Niektoré štúdie naznačili, že to môže byť užitočné pri inhibícii karcinogénnych nádorov, pre zdravie očí, na kontrolu krvného tlaku, okrem iného.
Môže vám slúžiť: Kultúrne médiá: História, funkcia, typy, prípravaU zvierat
Spoločnou stratégiou na liečbu infekcií vírusu herpes I v mačkách je suplementácia lyzínu. Niektoré vedecké publikácie však preukazujú, že táto aminokyselina nemá v mačkách žiadne antivírusové vlastnosti, ale skôr pôsobí znížením koncentrácie arginínu.
V zdraví detí
Experimentálny príjem L-lizíny, pridaný do dojčenského mlieka počas dojčenia, sa ukázal ako prospešný pre zisk telesnej hmotnosti a vyvolávanie chuti do jedla u detí počas prvých štádií postnatálneho vývoja.
Prebytok L-lizínu však môže spôsobiť prehnané vylučovanie moču aminokyselín, neutrálne aj základné vlastnosti, čo vedie k ich telesnej nerovnováhe.
Prebytok suplementácie L-lizín môže skončiť represiou rastu a iných histologických účinkov v dôležitých orgánoch, pravdepodobne v dôsledku straty aminokyselín močom.
V tej istej štúdii sa tiež preukázalo, že suplementácia lyzínu zlepšuje výživové vlastnosti požitých rastlinných bielkovín.
Ďalšie podobné štúdie uskutočňované u dospelých a detí oboch pohlaví v Ghane, Sýrii a Bangladéši priniesli prospešné vlastnosti príjmu lyzínu na zníženie hnačky u detí a niektorých smrteľných respiračných podmienok u dospelých mužov u mužov u mužov.
Poruchy nedostatku lyzínu
Lysín je, rovnako ako všetky základné a neosenciálne aminokyseliny, potrebné na správnu syntézu bunkových proteínov, ktoré prispievajú k tvorbe organických systémov tela.
Označené nedostatky lyzínu v strave, pretože ide o esenciálnu aminokyselinu, ktorá nie je produkovaná telom, môže viesť k vývoju úzkostranných obrazov sprostredkovaných serotonínom, okrem hnačky, tiež súvisiace s receptormi serotonínu.
Odkazy
- Misa, s., & Bunnik a. M. (2015). Prispôsobenie lyzínu nie je účinná na prevenciu alebo liečbu mačacieho herpesvírusu 1 u mačiek: systematický prehľad. Veterinárny výskum BMC, jedenásť(1).
- Carson, n., Scally, b., Neill, D., & Carré, i. (1968). Sacharopinúria: Nová vrodená chyba metabolizmu lyzínu. Povaha, 218, 679.
- Colina R, J., Díaz E, M., Manzanilla M, L., Araque m, h., Martínez G, G., Rossini V, M., & Jerez-Timaure, n. (2015). Vyhodnotenie stráviteľných hladín lyzínu v strave s vysokou hustotou energie pre dokončenie ošípaných. Časopis MVZ Córdoba, dvadsať(2), 4522.
- Fellows, B. F. C. Jo., & Lewis, m. H. R. (1973). Metabolizmus lyzínu u cicavcov. Biochemický časopis, 136, 329-334.
- Fornazier, r. F., Azevedo, r. Do., Ferreira, r. R., & Varisi, V. Do. (2003). Lysín katabolizmus: prietok, metabolická úloha a regulácia. Brazílsky denník Plant Plant Physiology, pätnásť(1), 9-18.
- Ghosh, s., Smriga, m., Vuvor, f., Suri, D., Mohamed, h., Armah, s. M., & Scrimshaw, n. Siež. (2010). Vplyv prosby lyzínu na zdravie a chorobnosť u subjektov patriacich chudobným prímestským domácnostiam v Akkre v Ghane. American Journal of Clinical Nutrition, 92(4), 928-939.
- Hutton, C. Do., Perugini, m. Do., & Gerrard, J. Do. (2007). Inhibícia biosyntézy lyzínu: vyvíjajúca sa stratégia antibiotík. Molekulárne biosystémy, 3(7), 458-465.
- Kalogeropoul, D., Lafave, l., Schweim, K., Gannon, m. C., & Nuttall, f. Otázka. (2009). Požitie lyzínu výrazne zoslabuje glukózovú reakciu na požitú glukózu bez zmeny inzulínovej reakcie. American Journal of Clinical Nutrition, 90(2), 314-320.
- Nagai, h., & Takeshita, s. (1961). Výživový účinok suplementácie L-lyzín na rast dojčiat a detí. Japonská pediatria, 4(8), 40-46.
- O'Brien, s. (2018). Zdravotná čiara. Získané 4. septembra 2019, od www.Zdravotná čiara.com/výživa/lyzín-prínosy
- Zabriskie, T. M., & Jackson, M. D. (2000). Biosyntéza lyzínu a metabolizmus v húb. Správy o prírodných produktoch, 17(1), 85-97.

