Zákon Ritchter-Wenzel Čo je, príbehy, výroky, príklady
- 2051
- 384
- Blažej Hrmo
Ten Zákon Ritchter-Wenzel alebo recipročné proporcie je ten, ktorý uvádza, že hmotnostné pomery medzi dvoma zlúčeninami umožňujú určiť podiel tretej zlúčeniny. Je to jeden zo zákonov stechiometrie spolu so zákonom Lavoisier (zákon ochrany omše); Zákon o Proust (zákon definovaných rozmerov); a Daltonov zákon (zákon viacerých rozmerov).
Ritcher vyhlásil svoj zákon v roku 1792 v knihe, ktorá definovala základy stechiometrie, založenú na výskumných dielach Carla F Wenzel, ktorý v roku 1777 uverejnil prvú rovnocennú tabuľku pre kyseliny a základne.
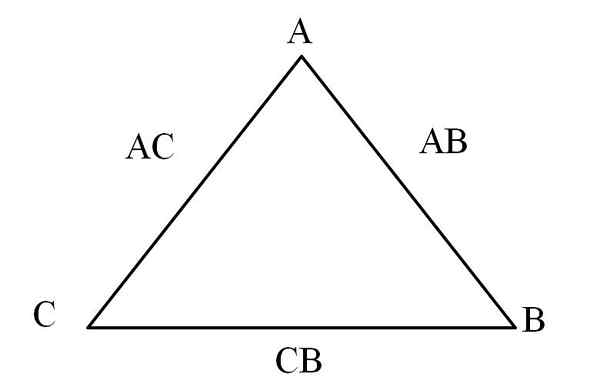
 Trojuholník. Zdroj: Gabriel Bolívar
Trojuholník. Zdroj: Gabriel Bolívar Jednoduchý spôsob, ako vizualizovať, je prostredníctvom „reciprocitného trojuholníka“ (vynikajúci obrázok). Ak sú známe hmotnosti A, C a B, ktoré sú zmiešané za vzniku zlúčenín AC a AB, je možné určiť, koľko z C a B sa zmieša alebo reaguje za vzniku zlúčeniny CB.
V zlúčeninách AC a AB je prítomný v oboch, takže pri delení ich hmotnostných pomerov je to, koľko C reaguje s B.
[TOC]
História a všeobecnosť práva recipročných rozmerov
Richter zistil, že hmotnostný podiel zlúčenín konzumovaných v chemickej reakcii je vždy rovnaký.
V tomto ohľade Ritcher zistil, že 615 častí je potrebných na základe hmotnosti magnézie (MGO), napríklad na neutralizáciu 1 000 dielov podľa hmotnosti kyseliny sírovej.
V rokoch 1792 až 1794 Ritcher uverejnil zhrnutie troch zväzkov, ktoré obsahovali jeho prácu na zákone definovaných rozmerov. Zhrnutie vyskúšalo stechiometriu a definovala ju ako umenie chemických meraní.
Môže vám slúžiť: chromatografia s jemnou vrstvou: Charakteristiky, čo je preUkazovanie, okrem toho, že stechiometria sa zaoberá zákonmi, podľa ktorých sú látky spojené s tvorbou zlúčenín. Richterove výskumné diela však boli kritizované za matematické zaobchádzanie, ktoré použil, pričom poznamenal, že upravil svoje výsledky.
V roku 1802 Ernst Gottfried Fischer publikoval prvú tabuľku chemických ekvivalentov, ktorá použila kyselinu sírovú s obrázkom 1000; Podobne ako hodnota, ktorú zistila Richter, pre neutralizáciu kyseliny sírovej pomocou magnézie.
Zdôraznilo sa však, že Richter postavil tabuľku kombinovaných pesos naznačujúcich pomer, v ktorom reagovalo množstvo zlúčenín. Napríklad je uvedené, že 859 častí NaOH neutralizuje 712 častí HNO3.
Vyhlásenia a dôsledky
Vyhlásenie o zákone Richtera-Wenzela je nasledujúce: masy dvoch rôznych prvkov, ktoré sú kombinované s rovnakým množstvom tretieho prvku, udržiavajte rovnaký vzťah ako masy týchto prvkov, keď sa navzájom kombinujú.
Tento zákon umožnil stanovenie ekvivalentnej hmotnosti alebo gramov s hmotnosťou, ako napríklad množstvo prvku alebo zlúčeniny, ktorá bude reagovať s pevným množstvom referenčnej látky.
Richter nazývaný ako kombinované hmotnosti súvisiace s hmotnosťami prvkov, ktoré boli kombinované s každým gramom vodíka. Richterove relatívne kombinované hmotnosti zodpovedajú tomu, čo sa v súčasnosti nazýva ekvivalentná hmotnosť prvkov alebo zlúčenín.
V súlade s predchádzajúcim prístupom možno Richter-Wenzel zákon uviesť takto:
Kombinované hmotnosti rôznych prvkov, ktoré sa kombinujú s určitou hmotnosťou daného prvku.
Môže vám slúžiť: metódy oddelenia heterogénnych zmesíPríklady
Chlorid vápenatý
Pri oxidu vápenatého (CAO) sa 40 g vápnika kombinuje so 16 g kyslíka (O). Medzitým v hypochlórnom oxidu (CL2O), 71 g chlóru sa kombinuje so 16 g kyslíka. Aká zlúčenina by sa vytvorila vápnik, ak by sa kombinoval s chlórom?
Pomocou reciprocitného trojuholníka je kyslík spoločným prvkom pre tieto dve zlúčeniny. Hmotnostné podiely týchto dvoch okysličených zlúčenín sú stanovené ako prvé:
40G Ca/16 Go = 5g Ca/2g alebo
71g Cl/16g alebo
A teraz delenie dvoch hmotnostných pomerov Cao a Cl2Alebo budeme mať:
(5g Ca/2g O)/(71g Cl/16g O) = 80 g Ca/142g Cl = 40 g Ca/71g Cl
Všimnite si, že zákon o hmotnostných rozmeroch je splnený: 40 g vápnika reaguje so 71 g chlóru.
Oxidy síry
Kyslík a síra reagujú s meďou, čím sa poskytne meď (CUO) a sulfid meďny (CUS), respektíve. Koľko by síra reagovala s kyslíkom?
V oxidu medi sa 63,5 g medi kombinuje so 16 g kyslíka. V medi sulfidu je 63,5 g medi spojených pri 32 g síry. Rozdelenie hromadných rozmerov, ktoré máme:
(63,5 g Cu/16g o)/(63,5 g Cu/32g s) = 2032g s/1016g o = 2g s/1g alebo
Hromadný pomer 2: 1 je násobok 4 (63,5/16), ktorý ukazuje, že Richterov zákon je splnený. S týmto pomerom sa získa SO, oxid síry (32 g síry so 16 g kyslíka).
Ak je tento podiel vydelený dvoma, bude tu 1: 1. Opäť je to teraz 4 alebo 2, a preto je to tak2, Oxid siričitý (32G Síra reaguje s 32 g kyslíka).
Môže vám slúžiť: fukóza: charakteristiky, štruktúra, funkcieSulfid a oxid železa
Reaguje sa sulfid železa (FES), v ktorom sa 32 g síry kombinuje s 56 g železa s železným (škaredým) oxidom, v ktorom je 16 g kyslíka kombinovaných s 56 g železa. Tento prvok slúži ako referencia.
V FES a škaredých reagujúcich zlúčeninách sa síra (S) a kyslík (O) vo vzťahu k železa (viera) nachádzajú v pomere 2: 1. V sírovom oxidu (SO) 32 g síry sa kombinujú so 16 g kyslíka, takže síra a kyslík sa nachádzajú v pomere 2: 1.
To naznačuje, že je splnený zákon recipročných rozmerov alebo zákon Richtera.
Podiel zistený medzi síry a kyslík v oxidu síry (2: 1) by sa mohol použiť napríklad na výpočet, koľko kyslíka reaguje s 15 g síry.
o Kyslík g = (15g S) ∙ (1 g O/2G S) = 7,5 g
Odkazy
- Zákon recipročného podielu: Definícia a príklad. Štúdium. Získané z: štúdie.com
- Zákon recipročných rozmerov. Chémia librettexts. Získané z: Chem.Librettexts.orgán

