HESS Vysvetlenie zákona, žiadosti, príklady
- 4121
- 1209
- Tomáš Mydlo
Ten Zákon Je to ďalší prejav zákona o ochrane energie, ktorý umožňuje určiť jednoduché algebraické sumy, entalpia chemickej reakcie. Pôvodom entalpou ako uvoľňovaného alebo absorbovaného tepla pri konštantnom tlaku, ktorý je spojený s akoukoľvek chemickou reakciou alebo chemickým javom.
Entalpies, ΔH, sa experimentálne určujú s použitím kalorimetrie. Existujú však reakcie, ktoré je ťažké s touto technikou študovať. Ak k tomu dôjde, používajú sa ďalšie reakcie, ktoré majú ich špecifické entalpie a ktoré majú záujmy alebo zlúčeniny, ktoré majú záujem.
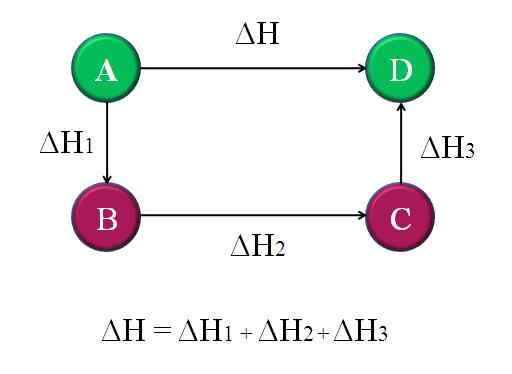
 Jednoduchý a všeobecný diagram, v ktorom sa uplatňuje zákon HESS pre štyri chemické reakcie. Zdroj: Gabriel Bolívar.
Jednoduchý a všeobecný diagram, v ktorom sa uplatňuje zákon HESS pre štyri chemické reakcie. Zdroj: Gabriel Bolívar. Týmto spôsobom je možné vypočítať „neznáme“ AH reakcie. Napríklad najvyšší diagram pomáha porozumieť tejto myšlienke. Existujú štyri reakcie: A-D, A-B, B-C a C-D. Reakcia A-D je tou, ktorá má najväčší AH, pretože v ktorej sa tak vyskytujú, najznámejšie chemické zmeny.
Ostatné reakcie, zatiaľ čo majú menšie AH, pretože pozostávajú z alternatívnych krokov alebo alternatívnych reakcií na dosiahnutie rovnakých produktov d. Preto súčet AH1, ΔH2 a ΔH3, Bude sa rovnať ΔH. Vedieť to, ΔH alebo akúkoľvek inú entalpiu, sa dá vypočítať použitím jednoduchých vyčistení. Toto je Hessov zákon.
Hessov zákon je veľmi užitočný pri výpočte reakčných entalpies, ako aj pri výcvikových entalpoch pre rôzne zlúčeniny alebo nestabilných sprostredkovateľov.
[TOC]
Vysvetlenie Hessovho zákona
Výpočet entalpie reakcie
Dôvod, prečo sa to splní:
ΔH = ΔH1 + ΔH2 + ΔH3
Je to preto, že entalpia alebo zmena entalpie je štátnou funkciou. To znamená, že ich hodnoty nie sú upravené počtom krokov, štádií alebo sprostredkovateľských reakcií. Napríklad AH zostane rovnaký, aj keď existuje AH10 ktoré by sa malo brať do úvahy v algebraickej sumre.
Entalpies by sa dali vizualizovať ako vrcholy niektorých hôr. Bez ohľadu na to, ako sú smerované kroky k nim, výška, ktorá ich oddeľuje od úrovne Mar, sa nikdy nemení. A presne to sú výšky, ktoré sa pridávajú alebo odpočítajú, aby sa určila neznáma výška okolitej hory.
Vráťte sa na predchádzajúci diagram: a, je to hora, inej hory a tak ďalej. Výškový rozdiel medzi vrcholmi A a D je najväčší. Pridanie výšok medzi A-B, B-C a C-D, bude sa rovná výške A-D. To sa robí s entalpiami ich príslušných chemických reakcií.
Môže vám slúžiť: fosfátová skupinaEntalpia reakcie z entalpií formácií
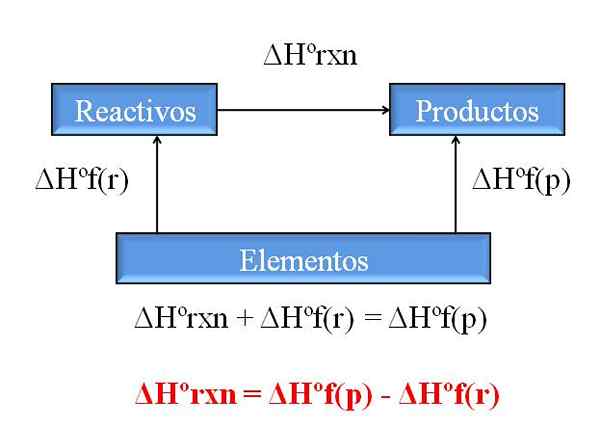 Všeobecný diagram na výpočet entalpie reakcie z entalpií útvarov. Zdroj: Gabriel Bolívar.
Všeobecný diagram na výpočet entalpie reakcie z entalpií útvarov. Zdroj: Gabriel Bolívar. Jedným z najcennejších dôsledkov Hessovho zákona je to, že umožňuje určovanie entalpií akejkoľvek chemickej reakcie, pričom sa školiace entalpie všetkých zlúčenín (činidiel a výrobkov) zapojených.
Tento bod ilustruje vynikajúci obrázok. Pôvodné entalpou pridruženej tvorby tepla, keď sa zlúčenina vytvorí z jej prvkov. Táto entalpia by sa stala maximálnym možným rozdielom medzi činidlami a výrobkami bez toho, aby sa musela konzultovať s inými chemickými reakciami; Aspoň mimo samostatného výcviku zlúčenín.
Ako tentoraz čítate diagram? Trik je vždy pridať entalpie, keď ide v smere šípky, a odčítať ich, keď je šípka na opačnej trase. Teda ΔHºRXN, štandardná reakčná entalpia, pridáva k AHºF (reagencie), štandardnej entalpie tvorby činidiel a odčítajú.
Sumy reakcií
Schémy môžu byť veľmi komplikované na interpretáciu, najmä ak existuje veľa reakcií, ktoré sa musia brať do úvahy. Preto sa používa súčet reakcií. Táto metóda výrazne uľahčuje výpočet entalpií a urýchľuje pochopenie Hessovho zákona.
Predpokladajme napríklad, že chcete určiť ΔHºRxn nasledujúcej reakcie:
A + B + C → ABC
A máme tiež ďalšie dve reakcie:
A + B → AB (ΔHº1)
AB + C → ABC (AHº2)
Je zaujímavé, že A + B + C sú na ľavej strane (činidlá) a že ABC je na pravej strane (výrobky). Potom jednoducho pokračujeme v pridaní posledných dvoch reakcií:
A + B → AB
AB + C → ABC
A + AB + C → ABC + AB
Pretože AB je z oboch strán, je eliminovaný. A tak máme:
A + B + C → ABC
ΔHºRXn = ΔHº1 + ΔHº2
Pridanie reakcií je použitie akéhokoľvek diagramu vynechané.
Aplikácie Hessovho zákona
Hessov zákon umožňuje bez potreby experimentov entalpie pre rôzne chemické reakcie alebo javy. Niektoré z nich sú uvedené:
- Školiace entalpie pre nestabilné zlúčeniny alebo sprostredkovateľov, ako zvyčajne v organickej chémii.
-Entalpie fázových prechodov, v štúdiu kryštalických tuhých látok.
Môže vám slúžiť: chemická zlúčenina-Entalpie alotropných prechodov, ako je napríklad medzi grafitom a diamantom.
Podobne sa Hessov zákon používa na určenie retikulárnej energie tuhej látky a elektronické afinity niektorých atómov.
Príklady: Vyriešené cvičenia
- Príklad 1
Vypočítajte AHRXN nasledujúcej reakcie:
2HCl (g) + f2g) → 2HF (l) + cl2g)
Ak máte nasledujúce reakcie a ich príslušné entalpie:
4hcl (g) + alebo2g) → 2h2Alebo (l) + 2cl2(g) (ΔH = -202.4 kJ/mol)
1/2H2(g) + 1/2f2(G) → HF (L) (AH = -600.0 kj/mol)
H2(g) + 1/2o2g) → H2Alebo (l) (ΔH = -285.8 kJ/mol)
Objednávanie rovníc
Na začiatok musíme pridať reakcie takým spôsobom, že HCl a F2 sú na ľavej strane a HF a CL2, Napravo. Ale dôležitejšie je, že si to všimne, že toľko h2 ako h2Alebo nie sú v úrokovej rovnici. Preto ich musíme zrušiť v sume a urobiť stechiometrické koeficienty sa zhodovať pomocou multiplikácií:
2HCl (g) + 1/22g) → H2Alebo (l) + cl2(g) (ΔH = -202.4 kJ/mol) * (1/2)
Táto rovnica bola vynásobená 1/2, aby mala 2HCl namiesto 4HCl
H2g) + f2(G) → 2HF (L) (AH = -600.0 kj/mol) * (2)
Táto rovnica vynásobená 2, aby mala f2 a č. 1/2f2
H2Alebo (l) → h2(g) + 1/2o2(G) (ΔH = -285.8 kJ/mol) * (-1)
Medzitým sa to znásobilo -1, aby „otočili“. Preto máme objednané rovnice a pripravené na pridanie.
Súčet rovníc
Pridanie všetkého nám dáva:
2HCl (g) + 1/22g) → H2Alebo (l) + cl2(g) (ΔH = -101.2 kJ/mol)
H2g) + f2(G) → 2HF (L) AH = -1200.0 kj/mol)
H2Alebo (l) → h2(g) + 1/2o2(G) (ΔH = 285.8 kJ/mol)
2HCl (g) + f2g) → 2HF (l) +cl2g)
Všimnite si, že výrazy 1/22, H2Alebo h2 Sú zrušené, pretože sú na oboch stranách šípky. Pridajú sa aj entalpies, dáva:
ΔHRX = 285.8 kJ/mol + (-101.2 kJ/mol) + (-1200.0 kj/mol)
Tento výraz je rovnaký ako začiatok:
ΔH = ΔH1 + ΔH2 + ΔH3
A tak máme, že AHRX sa rovná:
ΔHRX = -1015.4 kJ/mol
- Príklad 2
V tomto príklade bude zrejmé, že entalpie alternatívnych reakcií zodpovedajú entalpiam tvorby záujmových zlúčenín.
Je potrebné určiť AHRXN pre ďalšiu rozkladovú reakciu:
2So3g) → 2SO2g) + alebo2g)
A školiace entalpie zlúčenín SO sa počítajú po ruke3 A tak2:
S (s) + o2g) → SO2(g) (ΔH = -296.8 kJ/mol)
Môže vám slúžiť: Isopreno: Štruktúra, vlastnosti, aplikácieS (s) + 3/2o2g) → SO3(G) (ΔH = -395.6 kJ/mol)
Objednávanie rovníc
Toto cvičenie sa vyrieši rovnakým spôsobom ako predchádzajúci príklad. Malo by to tak3 mať pravdu a vynásobte 2. Z tohto3 Vynásobenie jeho -1 a potom jeho vynásobením 2:
2So3g) → 2s (s) + 3o2(G) (ΔH = -395.6 kJ/mol) * (-2)
Rovnica formovania SO2 Tiež to vynásobíme 2:
2s (s) + 22g) → 2SO2(g) (ΔH = -296.8 kJ/mol) * (2)
Súčet rovníc
Teraz sú rovnice pridané:
2So3g) → 2s (s) + 3o2(G) (ΔH = 791.2 kJ/mol)
2s (s) + 22g) → 2SO2(G) (ΔH = -593.6 kJ/mol)
2So3g) → 2SO2g) + alebo2g)
Všimnite si, že termín 2S je eliminovaný, pretože je na oboch stranách šípky. Tiež 32 2o sa odpočítava2 dávať O2. Súčet entalpií, a preto hodnota ΔHRXN bude:
ΔH = ΔHrxn = 791.2 kJ/mol + (-593.6 kJ/mol)
= 197.6 kJ/mol
Rovnako ako každá rozkladová reakcia, je endotermická, takže jej entalpia je pozitívna.
Alternatívna metóda
Existuje metóda na dosiahnutie toho istého výsledku priamejším a jednoduchším spôsobom. Toto bolo uvedené v predchádzajúcej časti.
2So3g) → 2SO2g) + alebo2g)
Na stanovenie AHRXN tejto reakcie musíme vypočítať δHºF (reagenty) a ΔHºF (produkty). ΔHºF (SO3) sa rovná -395.6 kJ/mol, zatiaľ čo ΔHºf (SO2) sa rovná -296.8 kJ/mol. ΔHºF (alebo2) sa rovná 0, pretože elementárny kyslík existuje ako molekula O2 A nie ako atómy alebo zadarmo.
Takže máme:
ΔHrxn = ΔHºF (produkty) - AHºF (Reagenty)
= [ΔHºF (SO2) + ΔHºF (alebo2)] - ΔHºF (SO3)
= ΔHºF (SO2) - ΔHºf (SO3)
Musíme však vynásobiť obidve školiace entalpies 2, aby sme zodpovedali stechiometrickým koeficientom vzhľadom na chemickú rovnicu:
ΔHrxn = 2AHºf (SO2) - 2AHºF (SO3)
A výpočet, ktorý máme:
Δhrxn = 2 (-296.8 kJ/mol) - 2 (-395.6 kJ/mol)
= 197.6 kJ/mol
V skutočnosti je to spôsob, akým sa zvyčajne uprednostňuje na vyriešenie všetkých cvičení, v ktorých sa uplatňuje zákon HESS.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2020). Hessov zákon. Zdroj: In.Wikipedia.orgán
- Cohen Shelly. (18. mája 2020). Hessov zákon. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Clark Jim. (2010). Výpočty zmien Hessovho zákona a entalpie. Získané z: Chemguide.co.Uk
- HelMestine, Anne Marie, PH.D. (11. februára 2020). Definícia Hessovho zákona. Zotavené z: Thoughtco.com
- Foist Laura. (2020). Hessov zákon: Definícia, vzorec a príklad. Štúdium. Získané z: štúdie.com
- Quimitube. (2014). Teória 14 Termochémia: Výpočet entalpie reakcie Hessovho zákona. Obnovené z: Quimitube.com
- « Test napätia, ako sa to robí, vlastnosti, príklady
- Test kompresie, ako sa vykonáva, vlastnosti, príklady »

