Charles Law Formulas a jednotky, experiment, cvičenia

- 3268
- 353
- Denis Škriniar
Ten Charles zákon alebo Guy-Lussac je taký, ktorý umožňuje vyhlásenie o jednom z vlastností plynného stavu: objem, ktorý plyn zaujíma, je priamo úmerný teplote pri konštantnom tlaku.
Táto proporcionalita je lineárna pre všetky rozsahy teplôt, ak je daný plyn ideálny; Kráľovské plyny sa na druhej strane líšia od lineárneho trendu pri teplotách blízko kondenzačného bodu. To však neobmedzovalo použitie tohto zákona pre nekonečné aplikácie, na ktorých sa zúčastňujú plyny.
 Čínske lucerny alebo želania. Zdroj: pxhere.
Čínske lucerny alebo želania. Zdroj: pxhere. Jednou z par excelentnosti Charlesovho zákona je prítomnosť v aerodynamických balónoch. Ďalšie jednoduchšie balóny, ako sú túžby, tiež nazývané čínska lampa.
Prečo konštantný tlak? Pretože ak by sa tlak zvýšil, znamenalo by to, že nádoba, v ktorej je plyn umiestnený, je pevne zatvorený; A s tým, zrážky alebo vplyvy plynných častíc proti vnútorným stenám uvedeného kontajnera (Boyle-Maleotte Law) by zvýšili zrážky alebo vplyvy vnútorných častíc (zákon Boyle-Maleotte).
Preto by nedošlo k zmene objemu obsadeného plynom a Charlesov zákon by nebol prísny. Na rozdiel od hermetického kontajnera predstavuje tkanivo balónov túžob mobilnú bariéru, ktorá je schopná expandovať alebo sťahovať v závislosti od tlaku vyvíjaného plynu vo vnútri.
Keď sa však balónový tkanivo rozširuje, vnútorný tlak plynu zostáva konštantný, pretože zvyšuje plochu, cez ktorú zrážajú jeho častice. Čím vyššia je teplota plynu, tým väčšia je kinetická energia častíc, a teda počet kolízií.
A keď sa Globe znova rozširuje, zrážky proti svojim vnútorným stenám zostávajú konštantné (v ideálnom prípade).
Čím je plyn horúci, tým väčšie je rozšírenie zemegule a tým viac stúpne. Výsledok: červenkasté (aj keď nebezpečné) svetlá zavesené na oblohe v noci v decembri.
[TOC]
Čo je to Charlesov zákon?
Vyhlásenie
Takzvaný zákon Charlesa alebo homosexuál-Lussac zákon vysvetľuje závislosť, ktorá existuje medzi objemom obsadeným plynom a hodnotou jeho absolútnej teploty alebo teploty Kelvin.
Zákon môže byť vyhlásený nasledovne: ak tlak zostáva konštantný, je splnený, že „pre danú hmotnosť plynu zvyšuje svoj objem o 1/273 -krát približne svoj objem na 0 ° C, pre každý stupeň Centigrade (1 ° C (1 ° C (1 ° CC ), ktorá zvyšuje jeho teplotu “.
Pracovné miesta
Výskumné diela, ktoré umožnili stanovenie zákona, začal v 80. rokoch 20. storočia Jacques Alexander Cesar Charles (1746-1823). Charles však nezverejnil výsledky svojich vyšetrovaní.
Následne sa Johnovi Daltonovi v roku 1801 podarilo experimentálne určiť, že všetky plyny a výpary, ktoré študovali, sa rozširujú medzi dvoma určenými teplotami v rovnakom objeme. Tieto výsledky potvrdil Gay-Lussac v roku 1802.
Výskumné diela Charlesa, Daltona a Gay-Lussacu umožnili preukázať, že objem obsadený plynom a jeho absolútna teplota sú priamo úmerné. Preto existuje lineárny vzťah medzi teplotou a objemom plynu.
Môže vám slúžiť: metódy oddelenia heterogénnych zmesíGraf
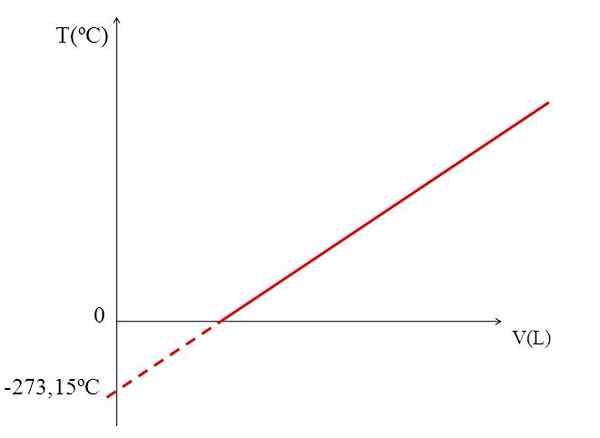 T vs v graf pre ideálny plyn. Zdroj: Gabriel Bolívar.
T vs v graf pre ideálny plyn. Zdroj: Gabriel Bolívar. Realizácia grafu (horného obrázka) objemu plynu oproti teplote vytvára priamu čiaru. Priesečník čiary s osou x pri teplote 0 ° C umožňuje získať objem plynu pri 0 ° C.
Podobne by križovatka čiary s osou X poskytla informácie o teplote, pre ktorú by objem obsadený plynom bol nula „0“. Dalton odhadol túto hodnotu pri -266 ° C, blízko hodnoty navrhnutej Kelvinom pre absolútnu (0) absolútnu.
Kelvin navrhol teplotnú stupnicu, ktorej nula by mala byť teplota, pri ktorej by perfektný plyn mal objem nuly. Ale pri týchto nízkych teplotách sú plyny skvapalnené.
Z tohto dôvodu nemôžeme hovoriť o objemoch plynov ako takých, zisťujeme, že hodnota pre absolútnu nulu by mala byť -273,15 ° C.
Vzorce a merací jednotky
Vzorce
Charlesov zákon vo svojej modernej verzii naznačuje, že objem a teplota plynu sú priamo úmerné.
Tak:
V / t = k
V = objem plynu. T = Kelvinová teplota (k). K = proporcionálnosť konštanta.
Pre zväzok V1 a teplota t1
k = v1 / T1
Tiež pre objem V2 a teplota t2
k = v2 / T2
Potom, porovnávať dve rovnice pre k, máte
Vložka1 / T1 = V2 / T2
Tento vzorec je možné napísať takto:
Vložka1 · T2 = V2 · T1
Čistenie v2, Získa sa vzorec:
Vložka2 = V1 · T2 / T1
Jednotky
Objem plynu môže byť vyjadrený v litroch alebo v ktorejkoľvek z jeho odvodených jednotiek. Podobne je možné objem vyjadriť v kubických merároch alebo v akejkoľvek odvodenej jednotke. Teplota musí byť vyjadrená pri absolútnej teplote alebo kelvinovej teplote.
Takže, ak sú teploty plynu vyjadrené v stupnici Celzia alebo Celzia, aby sa s nimi vykonal výpočet, malo by sa k teplotám pridať množstvo 273,15 ° C, aby sa dostali do absolútnych teplôt alebo kelvinov.
Ak sú teploty vyjadrené v stupňoch Farenheita, malo by sa pridať k týmto teplotám 459,67 ° R, aby ich priviedli k absolútnym teplotám v Rankine Scale.
Ďalší známy vzorec Charlesovho zákona a priamo súvisiaci s jeho vyhlásením je nasledujúci:
Vložkatón = Vani (1 + t/273)
Kde vtón Je to objem obsadený plynom pri určitej teplote, vyjadrený v litroch, cm3, atď.; a vani Je to objem obsadený plynom pri 0 ° C. Pokiaľ ide o svoju časť, T je teplota, pri ktorej sa meranie objemu vykonáva, vyjadrená v Celzia (° C) stupňoch (° C).
A nakoniec, 273 predstavuje absolútnu nulovú hodnotu na stupnici teploty Kelvin.
Experiment na demonštráciu zákona
Montáž
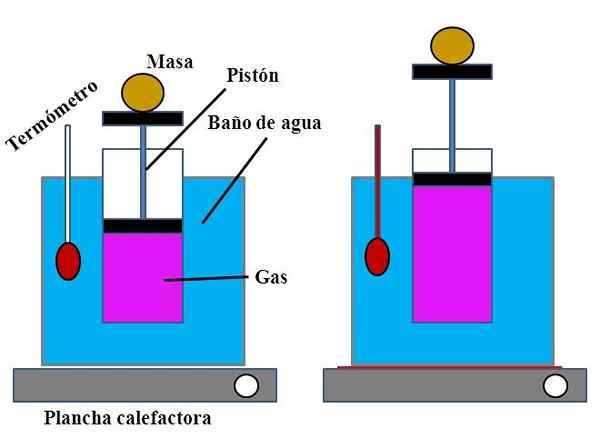 Zhromaždenie experimentu na preukázanie Charlesovho zákona. Zdroj: Gabriel Bolívar.
Zhromaždenie experimentu na preukázanie Charlesovho zákona. Zdroj: Gabriel Bolívar. Vo vodnej nádobe, ktorá splnila funkciu vodného kúpeľa, bol otvorený valec umiestnený jeho hornou časťou s piestom, ktorý sa prispôsobil vnútornej stene valca (vynikajúci obraz).
Tento piest (tvorený piestom a dvoma čiernymi základňami) by sa mohol presunúť do hornej alebo dolnej časti valca v závislosti od objemu plynu, ktorý obsahoval.
Vodný kúpeľ by sa mohol zahriať pomocou ľahšej alebo vykurovacej elektrárne, ktorá dodáva teplo potrebné na zvýšenie teploty kúpeľne, a preto teplota valca vybaveného piestom.
Môže vám slúžiť: Hydroxid vápenatý (Ca (OH) 2): Štruktúra, vlastnosti, získanie, použitiaNa piest sa umiestnila určitá hmota, aby sa zabezpečilo, že experiment sa uskutočnil pri konštantnom tlaku. Teplota kúpeľne a valca sa merala pomocou teplomeru umiestneného vo vodnom kúpeli.
Aj keď pravdepodobne valec nemala promóciu na vizualizáciu objemu vzduchu, dalo by sa to odhadnúť meraním výšky, ktorú hmota umiestnená na piest a povrchu valca základne.
Rozvoj
Objem valca sa získa vynásobením povrchu jeho základne jeho výškou. Povrch základu valca sa dal získať použitím vzorca: s = pi x r2.
Zatiaľ čo výška sa získa meraním vzdialenosti od spodnej časti valca, k piestu, na ktorom leží cesto.
Keď sa teplota kúpeľne zvýšila o teplo produkovaného zapaľovačom, bolo pozorované, že piest valca stúpa vo valci. Potom čítajú teplotu vo vodnom kúpeli v teplomere, ktorý zodpovedal vnútra valca.
Meria tiež výšku cesta na pieneri a sú schopní odhadnúť objem vzduchu, ktorý zodpovedal nameranej teplote. Týmto spôsobom vykonali niekoľko meraní teploty a odhady objemu vzduchu zodpovedajúce každej z teplôt.
To by nakoniec mohlo preukázať, že objem obsadený plynom je priamo úmerný jeho teplote. Tento záver, ktorý umožnil uviesť tak -zavolaný zákon Charlesa.
Globo s ľadom v zime
Okrem predchádzajúceho experimentu je tu jednoduchšia a kvalitatívnejšia: v zime balón s ľadom.
Keby bol v zime umiestnený balón plný hélia v miestnosti s vykurovaním, glóbus by mal určitý objem; Ale ak sa potom presunie do exteriéru domu s nízkou teplotou, bolo by pozorované, že héliový balón sa zmenšuje, čím sa zníži jeho objem podľa Charlesovho zákona.
Vyriešené cvičenia
Cvičenie 1
Máte plyn, ktorý zaberá objem 750 cm3 pri 25 ° C: Aký bude objem, ktorý tento plyn zaberá pri 37 ° C, ak sa udržiava konštantný tlak?
Je potrebné najprv transformovať teplotné jednotky na Kelvin:
Tón1 V stupňoch kelvin = 25 ° C + 273,15 ° C = 298,15 K
Tón2 V stupňoch kelvin = 37 ° C + 273,15 ° C = 310,15 K
Pretože je známy v1 a ďalšie premenné, vyčistí V2 A počíta sa s nasledujúcou rovnicou:
Vložka2 = V1 · (T2 / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Cvičenie 2
Aká by bola teplota stupňov Celzia, do ktorej by sa 3 litre plynu malo zahriať na 32 ° C, takže jeho objem sa rozširuje na 3,2 litra?
Opäť platí, že stupne Celzia v Kelvine sú transformované:
Tón1 = 32 ° C + 273,15 ° C = 305,15 K
A ako v predchádzajúcom cvičení, t sa vyčistí2 Namiesto V2, a potom vypočíta:
Tón2 = V2 · (T1 / V1)
= 3,2 l · (305,15 K / 3 l)
= 325,49 K
Vyhlásenie však žiada o stupne Celzia, takže sa zmení jednotka T2:
Tón2 V stupňoch Celzia = 325, 49 ° C (k) - 273,15 ° C (k)
Môže vám slúžiť: Pascal striekačka= 52,34 ° C
Cvičenie 3
Ak plyn pri 0 ° C zaberá objem 50 cm3, Aký objem bude obsadiť pri 45 ° C?
Použitím pôvodného vzorca Charlesovho zákona:
Vložkatón = Vani (1 + t /273)
Pokračujte pri výpočte Vtón Priamo, keď nakladáte so všetkými premennými:
Vložkatón = 50 cm3 + 50 cm3 · (45 ° C / 273 ° C (k))
= 58,24 cm3
Na druhej strane, ak sa problém vyrieši pomocou stratégie príkladov 1 a 2, budeme mať:
Vložka2 = V1 · (T2 / T1)
= 318 k · (50 cm3 / 273 k)
= 58,24 cm3
Výsledok, ktorý uplatňuje tieto dva postupy, je rovnaký, pretože sú v konečnom dôsledku založené na rovnakom zásade zákona Charlesa.
Žiadosti
Priania
Balóny želaní (už uvedené v úvode) sú vybavené textilným materiálom impregnovaným horľavou tekutinou.
Keď požiar požiarne tento materiál, v zemegule dochádza k zvýšeniu teploty vzduchu, čo spôsobuje zvýšenie objemu plynu podľa Charlesovho zákona.
Preto zvýšením objemu vzduchu na svete sa v ňom znižuje hustota vzduchu, čo sa robí menej ako hustota okolitého vzduchu, a preto Globe stúpa.
Pop-up teplomery alebo morky
Ako je uvedené podľa jeho názvu, používajú sa počas varenia moriek. Teplomer má nádobu plnú uzavretého vzduchu s vekom a je kalibrovaný takým spôsobom, že pri dosahovaní optimálnej teploty varenia sa veko zdvihne emitovaním zvuku.
Teplomer je umiestnený vo vnútri moriaka a keď sa teplota zvyšuje vo vnútri rúry, vzduch vo vnútri teplomeru sa rozširuje, čím sa zvyšuje objem. Takže keď objem vzduchu dosiahne určitú hodnotu, vytvára zdvíhací výťah teplomer.
Zotavenie formy ping-pongových guličiek
Gule ping-pong v závislosti od požiadaviek ich používania majú ľahkú hmotnosť a ich plastové steny sú malé hrubé. Vďaka tomu sú ovplyvnené raketami, ktoré trpia deformáciami.
Umiestnením deformovaných guličiek do horúcej vody sa vzduch vo vnútri zahrieva a dochádza k jeho expanzii, čo vedie k zvýšeniu objemu vzduchu. To tiež spôsobuje úsek steny ping-pongových guličiek, čo umožňuje obnovenie pôvodnej podoby.
Vypracovanie PAE
Kvasinky sú začlenené do pšeničnej múky, ktorá sa používa na výrobu chleba a má schopnosť produkovať plyn s oxidom uhličitého.
Zvýšením teploty chleba počas varenia sa objem oxidu uhličitého zvyšuje. Z tohto dôvodu dochádza k rozšíreniu chleba, kým sa nedosiahne požadovaný objem.
Odkazy
- Clark J. (2013). Oter Gasov zákony - Boyleov zákon a Charlesov zákon. Získané z: Chemguide.co.Uk
- Staroscik Andrew. (2018). Charlesov zákon. Zdroj: Scienteprimer.com
- Wikipedia. (2019). Charles zákon. Zdroj: In.Wikipedia.orgán
- Helmestín, Todd. (27. decembra 2018). Aký je vzorec pre Charlesov zákon? Zotavené z: Thoughtco.com
- Profesor. N. Leva. (s.F.). Zákony o elementárnom plyne: Charles Law. C 101 poznámky triedy. Získané z: iun.Edu
- Briceño Gabriela. (2018). Charles zákon. Získané z: Euston96.com
- Morris, J. G. (1974). Fyzikálna konanie pre biológov. (2dávať vydanie). Redakčné Reverté, s.Do.
- « Štrnásť bodov Wilsona pozadia a ako to ovplyvnilo Nemecko
- Aplikácie konceptov energie, sily, sily, práce »

