Ionizácia vo fyzike a koncepcii chémie, procesu a príklady

- 3176
- 556
- Alfréd Blaho
Ten ionizácia Je to všetko proces, v ktorom sa elektrické zaťaženie generuje z neutrálnych častíc. Môže sa to uskutočniť rôznymi prírodnými mechanizmami alebo silami, buď žiarením, teplom, elektrickými poľami, magnetickými poliami alebo chemickými reakciami. Ióny sa vyrábajú v dôsledku toho, ktoré sú pozitívne alebo negatívne zaťažené atómy.
Ionizácia je základným procesom pre symfíny fyzikálnych, chemických alebo prírodných javov, pričom posledne menované je mnohokrát zmes fyzikálno -chemických zmien. Napríklad pri fyzikálnych ionizáciách sa v zásade nevyskytujú chemické reakcie; To znamená, že výroba iónov neznamená poruchu alebo tvorbu nových odkazov.
 Mnoho prírodných javov, ako sú napríklad severné svetlá, sú založené na ionizácii molekúl atmosféry. Zdroj: Pixabay.
Mnoho prírodných javov, ako sú napríklad severné svetlá, sú založené na ionizácii molekúl atmosféry. Zdroj: Pixabay. Avšak v prírodných javoch je táto ionizácia zvyčajne sprevádzaná chemickými reakciami, ako je napríklad tvorba ozónu v nízkych výškach. Počas búrok sa vytvárajú oxidy dusíka z dusíka aj kvôli lúčom a ich intenzívnym teplotám, ktoré oxidujú dusík vzduchu.
Na druhej strane sa ionizácia môže preniknúť: v tej istej vode, v trení medzi dvoma povrchmi, v oxidáciách kovov alebo v rozpustení určitých plynov vo vode.
[TOC]
Ionizácia chémie
Oxidačná redukcia
 Počas prevádzky batérií hračky sú ióny a elektróny neustále. Zdroj: D J Shin/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)
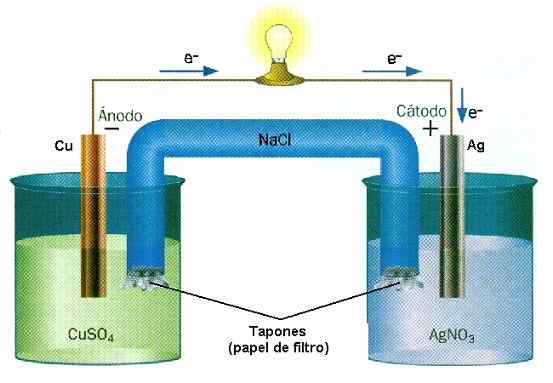
Počas prevádzky batérií hračky sú ióny a elektróny neustále. Zdroj: D J Shin/CC By-SA (https: // creativeCommons.Org/licencie/By-SA/3.0) V chemickej ionizácii sa ióny vyrábajú rozbitím alebo tvorbou odkazov. Dve látky zarábajú alebo stratia elektróny nezvratne: tá, ktorá stráca elektróny, získava kladné zaťaženie, zatiaľ čo ten, ktorý vyhrá.
 Príklad redukcie reakcie oxidu v hromade Cu-AG. Zdroj: Vodná stena/CC BY-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/)
Príklad redukcie reakcie oxidu v hromade Cu-AG. Zdroj: Vodná stena/CC BY-SA (http: // creativeCommons.Org/licencie/By-SA/3.0/) V batériách látka stráca elektróny, zatiaľ čo iný ich vyhrá. Tieto elektróny cestujú a aktivujú elektrické obvody zariadenia, aby sa konečne vrátili do druhej hromady, kde ich druhá látka čaká, aby ich chytili a negatívne naložili. Toto je príklad chemickej ionizácie vykonávanej reakciou na redukciu oxidu.
Môže vám slúžiť: kyselina glukónová: Štruktúra, vlastnosti, syntéza, použitieHeterolytické prasknutie
Ďalší typ chemickej ionizácie je spôsobený heterolitickým prasknutím. Ak dôjde k tejto prestávke, odkaz A-B je prerušený tak, aby vytvoril ióny+ a b-, Pretože elektróny sú nasmerované na atóm, pre ktorý sa „cítia“ väčšia afinita. Heterolitické prasknutie je zvyčajne prvým krokom, ktorý riadi mechanizmy mnohých organických reakcií.
Selfionizácia
Elektrické zaťaženia sa môžu objaviť nielen pomocou pohybu elektrónov samo osebe, ale aj odkazmi, ktoré sú rozbité alebo formované pri výmene atómov. Toto je prípad seba -izácie, ktorá sa deje medzi dvoma molekulami tej istej zlúčeniny.
Zo všetkých chemických ionizácií je samostatnosť najjednoduchšia a najprísnejšia, pretože nemá schopnosť vykonávať elektrický prúd sám o sebe.
Ionizácia vo fyzike
Statická elektrina
 Vlasy tohto dievčaťa sa nabíjajú pozitívne a odpudzujú sa navzájom kvôli statickej elektrine. Zdroj: Biseup Ganguly/CC od (https: // creativeCommons.Org/licencie/o/3.0)
Vlasy tohto dievčaťa sa nabíjajú pozitívne a odpudzujú sa navzájom kvôli statickej elektrine. Zdroj: Biseup Ganguly/CC od (https: // creativeCommons.Org/licencie/o/3.0) Ionizácia má tiež veľa účasti na fyzických javoch. Fyzikálna ionizácia vo všeobecnosti neznamená chemické reakcie. Atómy hmoty sa nabíjajú elektricky bez straty svojej pôvodnej identity.
Povrchy si môžu vymeniť elektróny, keď sa utierajú, ak je jeden z nich efektívnejší pri ich ukladaní, čo vedie k statickej elektrine. Už sa nehovorí o atómoch, ale o celom materiáli, ktorý získa negatívne alebo pozitívne zaťaženie, a že keď sa obnoví rovnováha, môže elektrický šok doslova generovať medzi dvoma materiálmi alebo telom.
Plynná ionizácia
Dispergované plynné atómy môžu stratiť elektróny, ak sú vystavené elektrickému poľu. Pritom sú atómy vzrušené a uvoľňované elektróny. Potom, keď sa ochladzuje a vrátia sa do svojho stavu menšej energie, Photons sa rozlúčia. A tento proces sa opakuje znova a znova. Výsledok: zdroj osvetlenia alebo elektriny.
Môže vám slúžiť: oxid bóru (B2O3): Čo je, štruktúra, vlastnosti, použitiaIonizácia ožarovania alebo zrážok
Podobne môže hmota získať energiu poskytovanú rôznymi typmi žiarenia (gama, x -roy, ultrafialové, atď.) alebo zrážkou s vysoko energetickými časticami (ALFA, beta a neutróny).
Prispela energia, že elektrón atómu je okamžitý. Tento typ ionizácie súvisí s viacerými rádioaktívnymi a kozmickými javmi.
Ionizácia
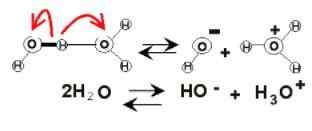 Disociácia vody
Disociácia vody V lone vody sa môžu objaviť elektrické náboje v dôsledku jej ionizácie. Je to chemikálie, pretože dve molekuly vody náhle reagujú na seba, aby sa disociovali a generovali H ióny3Ani+ a oh-:
2h2Alebo (l) ⇌ h3Ani+(Ac) + OH-(Ac)
Táto rovnováha bola veľmi vysídlená smerom k vode, takže nie je takmer žiadne opovrhnutiahodné množstvo týchto iónov.
Ionizácia vzduchu
Molekuly vzduchu sa nezúčastňujú na žiadnej rovnováhe seba -izácie. Kyslík, dusík, argón, vodná pary a ďalšie plyny, ktoré tvoria vzduch, nevymieňajú atómy alebo elektróny. Preto vzduch nie je dobrým vodičom elektriny za normálnych podmienok.
Ak je však vystavené elektrickému poľu, žiareniu alebo intenzívnym teplotám, môže to byť ión a stať sa dobrým vodičom. To sa stane napríklad, keď elektrické lúče padajú z mrakov na Zem a prechádzajú elektrónmi vzduchom s náhlym výbuchom svetla.
Príklady ionizácie
V predchádzajúcich častiach boli vymenované niektoré príklady ionizácie. Nakoniec sa spomínajú niektorí ďalší.
Oxidácia kovu
Keď kovy oxidujú, buď pôsobením kyslíka Zeme, alebo útokom kyslých látok.
Môže vám slúžiť: Chemický proces: princípy, typy, príkladyNapríklad železo je ionizované vďaka kyslíku, aby sa transformovalo na vieru ióny3+, Umiestnené v kryštáloch oxidov železa. Na druhej strane horčík sa rozpustí v kyseline sírovej, aby stratil elektróny a zostal ako mg ióny2+ V soli sulfátu horečnatého.
Rozpustenie plynov vo vode
Niektoré plyny, ako je amoniak a chlorid vodíka, sa rozpúšťajú vo vode, aby stratili svoju neutralitu a vedú k tvorbe iónov. Napríklad amoniak, keď rozpustí čiastočne uvoľňuje NH ióny4+ a oh-. Medzitým chlorid vodíka pri rozpustení bude produkovať H ióny3Ani+ a cl- úplne.
Podobným prípadom je rozpustenie solí vo vode, ako je síran horečnatý, MgSO4. Avšak mg ióny2+ A tak42- Už sú prítomné na kryštáloch soľných kryštálov pred rozpustením vo vode.
Osvetľovacie žiarovky alebo trubice

V parných žiarovkách alebo osvetľovacích skúmavkách sú atómy plynných s elektrickými otrasmi nadšené, že vytvorí určité množstvo svetla a farieb. Napríklad táto ionizácia sa koná v sodíkových alebo ortuťových žiarovkách, ako aj v slávnych neónových svetlách s ich jasnými farbami v reštaurácii alebo v obchodoch s obchodmi.
Ionizačné energie
Študuje sa ionizačná energia, periodická vlastnosť, ktorá charakterizuje chemické prvky podľa ľahkosti, s akou ich plynné atómy darujú svoje elektróny na pozitívne načítanie. Napríklad kovy majú zvyčajne najnižšiu ionizačnú energiu, zatiaľ čo nemetalické prvky a ušľachtilé plyny, najvyššie.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Serway, r., Jewett, J. (2008). Fyzika pre vedu a inžinierstvo. Zväzok 1. 7. Vydanie. Mexiko. Redaktori učenia sa Cengage.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2020). Ionizácia. Zdroj: In.Wikipedia.orgán
- Redaktori Enyclopaedia Britannica. (17. októbra 2016). Ionizácia. Encyclopædia Britannica. Získané z: Britannica.com
- Doug Stewart. (2018). Definícia ionizácie: Čo je ionizácia? Získané z: Chemicool.com
- John Zavisa. (1. apríla 2020). Ako funguje blesk. Získané z: vedy.Howstuffwork.com
- « 18 typov správania a ich charakteristiky (s príkladmi)
- Žltý liberalizmus pôvod, vlastnosti, príčiny, dôsledky »

