Imunoglobulíny
- 4093
- 109
- Václav Višňovský
 Ilustrácia imunoglobulínov
Ilustrácia imunoglobulínov Čo sú imunoglobulíny?
Ten Imunoglobulíny Sú to molekuly, ktoré vyrábajú B lymfocyty a plazmatické bunky, ktoré spolupracujú s obranou organizmu. Pozostávajú z biomolekuly glykoproteínu patriace do imunitného systému. Sú jedným z najhojnejších proteínov krvného séra po albumíne.
Protilátka je iné meno, ktoré imunoglobulíny dostávajú a sú považované za globulíny kvôli ich správaniu v elektroforéze krvného séra, ktoré ich obsahuje. Molekula imunoglobulínu môže byť jednoduchá alebo zložitá v závislosti od toho, či je vaša prezentácia ako monomér alebo je polymerizovaná.
Spoločná štruktúra imunoglobulínov je podobná písmena „y“. Existuje päť typov imunoglobulínov, ktoré majú morfologické, funkčné a polohové rozdiely v tele. Štrukturálne rozdiely protilátok nie sú vo forme, ale z hľadiska ich zloženia; Každý typ má špecifický cieľ.
Imunitná reakcia podporovaná imunoglobulínmi je veľmi špecifická a je veľmi komplexným mechanizmom. Stimul pre svoju sekréciu bunkami je aktivovaný v prítomnosti podivných látok v tele, ako je baktéria. Funkciou imunoglobulínu bude pripojiť sa k podivnému prvku a eliminovať ho.
Imunoglobulíny alebo protilátky môžu byť prítomné v krvi aj na membránovom povrchu orgánov. Tieto biomolekuly predstavujú dôležité prvky v systéme obrany ľudského tela.
Štruktúra imunoglobulínov

Štruktúra protilátok obsahuje aminokyseliny a uhľohydráty, oligosacharidy. Prevažná prítomnosť aminokyselín, jej množstvo a distribúcia je to, čo určuje štruktúru imunoglobulínu.
Rovnako ako každý proteín, aj imunoglobulíny majú primárnu, sekundárnu, terciárnu a kvartérnu štruktúru, ktorá určuje ich typický vzhľad.
V reakcii na počet aminokyselín, ktoré uvádzajú, majú imunoglobulíny dva typy reťazcov: ťažký reťazec a ľahký reťazec. Okrem toho, podľa aminokyselinovej sekvencie vo svojej štruktúre má každý z reťazcov premenlivú oblasť a konštantnú oblasť.
Ťažká reťaze
Ťažké reťazce imunoglobulínov zodpovedajú polypeptidovým jednotkám pozostávajúcim zo 440 aminokyselinových sekvencií.
Každý imunoglobulín má 2 ťažké reťazce a každá z nich má variabilnú oblasť a konštantnú oblasť. Konštantná oblasť má 330 aminokyselín a variabilné 110 aminokyseliny sekvenované.
Štruktúra ťažkého reťazca je iná pre každú imunoglobulín. Sú to celkom 5 typov ťažkých reťazcov, ktoré určujú typy imunoglobulínu.
Typy ťažkých reťazcov sú identifikované s gréckymi písmenami γ, μ, a, ε, δ pre igg, IgM, IgA, IgE a IgD imunoglobulíny.
Konštantná oblasť ťažkých reťazcov ε a μ sa tvoria štyrmi doménami, zatiaľ čo tie, ktoré zodpovedajú a, y, δ, majú tri. Potom sa každá konštantná oblasť bude líšiť pre každý typ imunoglobulínu, ale je spoločné pre imunoglobulíny rovnakého typu.
Môže vám slúžiť: sternocleidohioidný svalVariabilná oblasť ťažkého reťazca je tvorená jedinou doménou imunoglobulínu. Táto oblasť má sekvenciu 110 aminokyselín a bude sa líšiť v závislosti od špecifickosti protilátky antigén.
V štruktúre ťažkých reťazcov je možné pozorovať uhlík alebo flexiu - pánt - ktorý predstavuje flexibilnú plochu reťazca.
Ľahké reťazce
Svetelné reťazce imunoglobulínov sú polypeptidy pozostávajúce z približne 220 aminokyselín. V ľudskej bytosti existujú dva typy ľahkého reťazca: Kappa (K) a Lambda (λ), druhé so štyrmi podtypmi. Konštantné a variabilné domény majú sekvencie 110 aminokyselín.
Protilátka môže mať dva ľahké reťazce K (Kκ) alebo pár reťazcov A (λλ), ale nie je možné mať jeden z každého typu súčasne.
FC a FAB segmenty
Pretože každý imunoglobulín má formu podobnú „y“, možno rozdeliť na dva segmenty. „Spodný“ segment, báza, sa nazýva kryštalizovateľná frakcia alebo FC; zatiaľ čo ramená „y“ tvoria báječnú alebo frakciu, ktorá spája antigén. Každá z týchto štrukturálnych častí imunoglobulínu vykonáva inú funkciu.
FC segment
Segment FC má dve alebo tri konštantné domény ťažkých reťazcov imunoglobulínu.
FC sa môže spojiť s proteínmi alebo špecifickým prijímačom v bazofiloch, eozinofiloch alebo jačmeňových bunkách, takže indukuje špecifickú imunitnú odpoveď, ktorá eliminuje antigén. FC zodpovedá karboxylovému koncu imunoglobulínu.
Segment
Frakčný alebo FAB segment protilátky obsahuje variabilné domény na jej koncoch, okrem konštantných domén ťažkých a ľahkých reťazcov.
Konštantná doména ťažkého reťazca pokračuje s doménami segmentu FC, ktoré tvoria záves. Zodpovedá amino-terminálnym koncom imunoglobulínu.
Dôležitosť segmentu FAB je taká, že umožňuje spojenie s antigénmi, podivné a potenciálne škodlivé látky.
Variabilné domény každého imunoglobulínu zaručujú ich špecifickosť daným antigénom; Táto funkcia dokonca umožňuje jeho použitie pri diagnostike zápalových a infekčných chorôb.
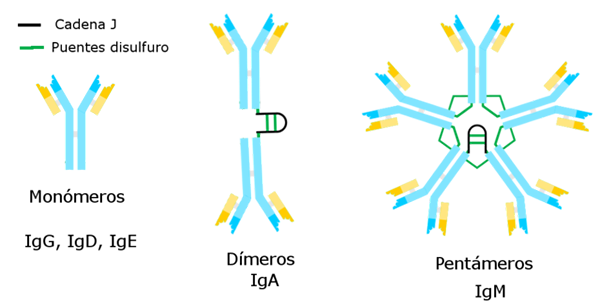
Typy imunoglobulínov
 Autor: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], cez Wikimedia Commons
Autor: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], cez Wikimedia Commons Imunoglobulíny známe doteraz majú špecifický ťažký reťaz, ktorý je konštantný pre každý z nich a rozdiel od ostatných.
Existuje päť odrôd ťažkých reťazcov, ktoré určujú päť typov imunoglobulínov, ktorých funkcie sú rôzne.
Imunoglobulín G (IgG)
Imunoglobulín g je najpočetnejšia rozmanitosť. Má ťažký gama reťazec a je prezentovaný v unimolekulárnej alebo monomérnej forme.
IgG je najhojnejší v krvnom sére aj v tkanivovom priestore. Minimálne zmeny v aminokyselinovej sekvencii svojho ťažkého reťazca určujú ich delenie do podtypov: 1, 2, 3 a 4.
Môže vám slúžiť: sarcomroImunoglobulín G má vo svojom segmente FC sekvenciu 330 aminokyselín a molekulovú hmotnosť 150 000, z čoho 105 000 zodpovedá jeho ťažkému reťazcu.
Imunoglobulín M (IgM)
Imunoglobulín M je pentage, ktorého ťažký reťazec je μm. Jeho molekulová hmotnosť je vysoká, približne 900 000.
Aminokyselinová sekvencia svojho ťažkého reťazca je 440 vo svojej frakcii FC. Je prevažne v krvnom sére, čo predstavuje 10 až 12 % imunoglobulínov. IGM má jediný podtyp.
Imunoglobulín A (IgA)
Ťažký reťazec a zodpovedá a predstavuje 15 % z celkových imunoglobulínov. IgA sa nachádza v krvi aj v sekrétoch, dokonca aj v materskom mlieku, ktorý sa vyskytuje vo forme monoméru alebo diméru. Molekulová hmotnosť tohto imunoglobulínu je 320 000 a má dva podtypy: IgA1 a IgA2.
Imunoglobulín E (IgE)
Immunoglobulín E je tvorený typom ε ťažkého reťazca a je veľmi vzácny v sére, okolo 0,002 %.
IgE má molekulovú hmotnosť 200 000 a je prítomný ako monomér hlavne v sére, nosovom hlienu a slinách. Je tiež bežné nájsť tento imunoglobulín v bazofiloch a žírnych bunkách.
Imunoglobulín D (IGD)
Odroda ťažkých reťazcov A zodpovedá imunoglobulínu D, ktorý predstavuje 0,2 % z celkových imunoglobulínov. IGD má molekulovú hmotnosť 180 000 a je štruktúrovaná vo forme monoméru.
Súvisí s B lymfocytmi, pripevnenými na povrch z nich. Funkcia IGD však nie je jasná.
Zmena
Imunoglobulíny môžu zažiť štrukturálnu zmenu typu, kvôli potrebe obrany proti antigénu.
Táto zmena je spôsobená funkciou B lymfocytov výrobných protilátok adaptívnou vlastnosťou imunity. Štrukturálna zmena je v konštantnej oblasti ťažkého reťazca bez zmeny premennej oblasti.
Zmena triedy alebo triedy môže spôsobiť, že IGM prejde na IgG alebo IgE, a to sa vyskytuje ako indukovaná odpoveď gama interferónom alebo IL-4 a IL-5 interleucínmi.
Funkcie imunoglobulínov
Úloha, ktorú hrá imunoglobulíny v imunitnom systéme, má zásadný význam pre obranu organizmu.
Imunoglobulíny sú súčasťou humorálneho imunitného systému; to znamená, že sú to látky vylučované bunkami na ochranu pred patogénmi alebo škodlivými látkami.
Poskytujú účinný obranný prostriedok, efektívne, špecifické a systematizované, majú veľkú hodnotu ako súčasť imunitného systému. Majú v rámci imunity všeobecné a špecifické funkcie:
Všeobecné funkcie
Protilátky alebo imunoglobulíny plnia nezávislé funkcie, ako aj aktivačné efektorové a sekrečné reakcie sprostredkované bunkami.
Antigén-úradník
Imunoglobulíny majú funkciu konkrétne a selektívne spojenie antigénnych látok.
Tvorba komplexu antigénov-protilátka je hlavnou funkciou imunoglobulínu, a preto je imunitná reakcia, ktorá môže zastaviť účinok antigénu. Každá protilátka sa môže súčasne spojiť s dvoma alebo viacerými antigénmi.
Môže vám slúžiť: alveolárna kosťÚčinné funkcie
Komplex antigénov-protilátka väčšinou slúži ako začiatok na aktiváciu špecifických bunkových odpovedí alebo spustenie sekvencie udalostí, ktoré určujú elimináciu antigénu. Dve najbežnejšie efektorové reakcie sú aktivácia zboru buniek a doplnku.
Bunkový zväz záviszuje od prítomnosti špecifických receptorov pre segment imunoglobulínu FC, keď sa pripojí k antigénu.
Bunky, ako sú žírne bunky, eozinofily, lymfocytové bazofily a fagocyty, majú tieto receptory a poskytujú mechanizmy eligénov.
Aktivácia vodopádu komplementu je komplexný mechanizmus, ktorý zahŕňa začiatok sekvencie, takže konečným výsledkom je sekrécia toxických látok, ktoré eliminujú antigény.
Konkrétne funkcie
Po prvé, každý typ imunoglobulínu vyvíja špecifickú obrannú funkciu:
Imunoglobulín g
- Imunoglobulín G poskytuje väčšinu obrany proti antigénnym činidlám vrátane baktérií a vírusov.
- Aktívne mechanizmy IgG, ako je komplement a fagocytóza.
- Špecifická ústava IgG pre antigén je odolná.
- Jedinou protilátkou, ktorú môže matka preniesť na deti počas tehotenstva, je IgG.
Imunoglobulín m
- IgM je protilátka s rýchlou reakciou pred škodlivými a infekčnými činidlami, pretože poskytuje okamžitú akciu, kým nebude nahradená IgG.
- Táto protilátka aktivuje bunkové reakcie začlenené do membrány humorálnych lymfocytov a reakcií, ako je komplement.
- Je to prvý imunoglobulín, ktorý syntetizuje ľudskú bytosť.
Imunoglobulín a
- Pôsobí ako bariéra obrany proti patogénom, keď sa nachádza na povrchoch slizníc.
- Je prítomný v respiračnej sliznici, tráviacom systéme, močových traktoch a tiež v sekrétoch, ako sú sliny, nosné sliznice a slzy.
- Aj keď je jej aktivácia doplnku nízka, môže byť spojená s hladkosťou pri odstraňovaní baktérií.
- Prítomnosť imunoglobulínu D v materskom mlieku aj v Caloster umožňuje novorodenca ho získať počas dojčenia.
Imunoglobulín e
- Imunoglobulín a poskytuje silný obranný mechanizmus proti výrobcom alergických výrobcov, ktorí produkujú.
- Interakcia IGE a alergén budú zapáliť zápalové látky zodpovedné za príznaky alergií, ako je kýchanie, kašeľ, úľ, zvýšenie sĺz a nazálne hlieny.
- IgE môže byť tiež spojený s povrchom parazitov prostredníctvom svojho segmentu FC, čím spôsobuje reakciu, ktorá spôsobuje smrť z nich.
Imunoglobulín D
- Monomérna štruktúra IgD je spojená s B lymfocytmi, ktoré neinteragovali s antigénmi, takže vykonávajú funkciu receptora.
- Funkcia IGD je nejasná.

