Chlórnan sodný (NACLO)
- 3539
- 535
- Mgr. Pravoslav Mokroš
Vysvetlíme, čo je chlórnan sodný, jeho vlastnosti, syntéza a aplikácie
 Vzorec a štruktúra chlórnanu sodného
Vzorec a štruktúra chlórnanu sodného Čo je chlórnan sodný?
On Chlórnan sodný (NACLO) je ternárna a anorganická soľ sodíka. Komerčne sa dosahuje ako vodné roztoky a je aktívnym činiteľom týchto domácich a priemyselných výrobkov. Tieto roztoky sú známe s názvami chlóru, belšie, sóda, belšie, belšie alebo, ešte rafinovanejšie, oštep.
Vo vode chlórnan sodný vykazuje rovnaké oxidačné vlastnosti plynného chlóru, takže roztok tejto soli je ekvivalentný k prenášaniu uvedenej zlúčeniny vo plastovej fľaši. V skutočnosti je chlór dostupný v týchto nádobách indikátorom koncentrácie a bieliacej sily roztoku chlórnanu sodného.
Táto ternárna soľ vo vode sa dá považovať za jednoduchý vodný roztok chlóru; K dispozícii sú však aj ďalšie formy, ako napríklad tuhá látka v prípade chlórnanu vápenatého a kvapalný chlór. Tieto tri majú rovnaký oxidačný výkon a ich použitia závisia od premenných, ako je pohodlie, výkon alebo čas.
Vzorec
Chemický vzorec chlórnanu sodného je Naclo. Je tvorený na katión+ A anión CLO-. Ióny+ Cítia elektrostatickú príťažlivosť pre ióny CLO-, Ten, ktorý prijíma tetraedrálnu štruktúru s hybridizáciou SP3.
Vzorec označuje podiel iónov v stave anhydridu, ktorý sa rovná 1: 1. Platí však iba pre anhydrid.
V prípade hydratovaného chlórnanu sodného -one najstabilnejších foriem pre tento chemický vzorec je Naclo · 5H2Ani.
Kde je chlórnan sodný?
NACLO je syntetický produkt a vďaka svojej reaktivite sa nachádza iba v miestnych oblastiach, kde sa používa, najmä v odpadových vodách, pôdach alebo dokonca v emanácii pitnej vody.
V ľudskom tele oplýva chloridové ióny, ktoré by sa mohli podieľať na redoxných reakciách, ktoré produkujú chlórnan sodný v organizme.
Môže vám slúžiť: oxidy kovovSyntéza
V celej histórii bol NACLO pripravený na niekoľko metód. Najjednoduchšie pozostáva z roztoku chlóru vo vode alebo roztokov NA2Co3 To vydanie CO2 Pôsobením kyseliny hypochlórnej (HCLO).
Iné metódy používajú morskú soľanku ako surovinu prostredníctvom elektrolytického procesu. Pod účinným mechanickým agitáciou, CL2 a NaOH generovaný NaCl a voda reaguje a stáva sa NACLO:
Cl2(g) + 2naoh (aq) => Naclo + NaCl + h2O + q (teplo)
Dnes Hooker proces vyrába túto zlúčeninu do veľkých mierok, ktoré pozostávajú z vylepšenej verzie opísanej predchádzajúcej metódy.
Použitie/aplikácie chlorita sodného
 Jednou z hlavných aplikácií chlóritu sodného je bielenie odevov
Jednou z hlavných aplikácií chlóritu sodného je bielenie odevov Najbežnejšie aplikácie chlórnanu sodného sú:
- Chlórnan sodný sa používa ako bieliace činidlo v textíliách, v detergentoch, ktoré ho zahŕňajú a do papierového priemyslu.
- Jeho použitie ako baktericídne a dezinfekčné činidlo je veľmi široké, pomocou čistenia vody a čistenia odpadových vôd.
- Jeho užitočnosť pri dezinfekcii zariadenia používaného pri príprave potravín a spracovaní ovocia a zeleniny je známa. Používa sa tiež s rovnakou dezinfekčnou funkciou pri výrobe húb, hovädzieho dobytka, ošípaných a hydiny.
- Chlórnan sodný sa používa v ropnom priemysle v fáze rafinácie.
- V domácnosti sa bieliaca kapacita chlórnanu sodného používa pri umývaní bielych odevov a dezinfekčnom pôsobení pri čistení kúpeľní, podlahách atď.
- Chlórnan sodný sa používa pri endodontickej terapii, konkrétne pri liečbe koreňa zubov. Toto ošetrenie používa roztok Dakin (klon až 0,5 %), ktorý zachováva životne dôležité zubné tkanivo pri rozpustení nekrotického tkaniva.
Vlastnosti chlórnanu sodného
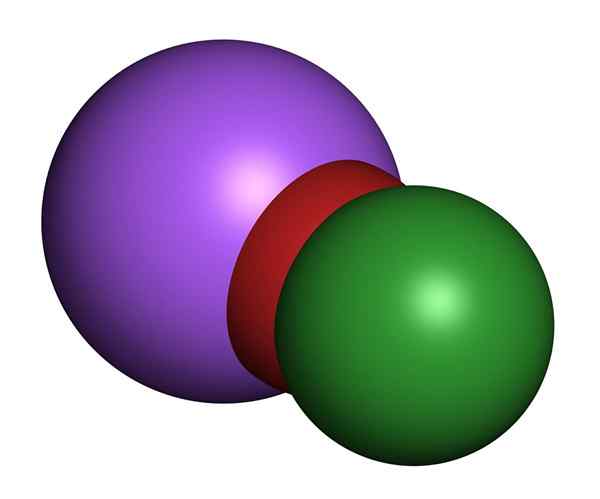 3D model chlórnanu sodného. Chlór (zelený), kyslík (červený), sodík (fialová)
3D model chlórnanu sodného. Chlór (zelený), kyslík (červený), sodík (fialová) Roztoky chlórnanu sodného pri izbovej teplote sú bezfarebné a majú vôňu sladkého chlóru. Fyzikálne vlastnosti sa líšia v závislosti od koncentrácií soli rozpustených vo vode. Všetky majú žlté sfarbenie.
Prostredníctvom kryštalizačných techník tieto roztoky získavajú pevnú NACLO · 5H2Alebo, ktorého kryštály sú zelené.
Táto hydratovaná soľ má približnú molekulovú hmotnosť 164 g/mol, hustota 1,11 g/ml, je veľmi rozpustná vo vode a rozkladá sa na 101 ° C. NACLO · 5H2Alebo je tiež citlivý na rovnaké reakcie anhydridu.
Prečo je soľ pentahydrát? Ako NACLO kryštalizuje vo svojom vodnom prostredí, molekuly vody zabaľujú ióny do vodnej gule.
Je možné si myslieť, že tri z týchto molekúl interagujú s nerezanými elektrónovými pármi CL: vodíkový mostík s O a posledný je priťahovaný k NA.
Štúdie zamerané na kryštalickú štruktúru tejto tuhej látky majú skutočnú odpoveď na túto otázku.
Vodná rovnováha
Anión CLO- Zúčastnite sa nasledujúcej rovnováhy hydrolýzy:
HCLO (AC) + H2Alebo (l) clo-(Ac) + h+(Ac)
Ak sa zvýši kyslosť roztoku, rovnováha sa presunie doľava a produkuje HCLO.
Táto kyselina je ešte nestabilnejšia ako chlórnan, a preto rozklad znižuje koncentráciu aktívneho činidla. Ak je pH základné (väčšie ako 11), zaručuje existenciu CLO- a životnosť produktu.
Avšak nadmerná alkalita vyvoláva vo svojich aplikáciách ďalšie problémy. Napríklad veľmi základné riešenie Naillo poškodzuje oblečenie namiesto toho, aby ho len bielilo.
Vo vodnom médiu sa HCLO tiež transformuje na chlór, čo vysvetľuje žlté sfarbenie týchto roztokov:
Môže vám slúžiť: Percentuálna koncentráciaHCLO (AC) CL2g) + h2Alebo (l)
Neprimeranosť
Atóm chlóru v chlórite sodného má oxidačný stav +1, ktorý potrebuje iba dva elektróny na dokončenie svojho oktetu Valencie.
Na druhej strane, jej elektronická konfigurácia je [ne] 3s23p5, Byť schopný vyprázdniť všetky elektróny svojich orbitálov „p“, viac energie.
To vedie k tomu, že chlórnan trpí reakciami na neúmerné ióny s oxidačnými stavmi +1 a +5:
3Cl-(Ac) 2cl-(ac) + clo3-(Ac)
Táto reakcia vo vodnom roztoku sa zrýchľuje so zvyšovaním teploty a koncentráciami chlórnanu. Podobne reakcia pokračuje iným mechanizmom katalyzovaným svetlom a oxidmi kovov medi, niklu a kobaltu:
2naocl (aq) => o2g) + 2NACL (aq)
Hneď ako navento je neprimerané oveľa rýchlejšou rýchlosť.
Oxidačný činiteľ
Atóm chlóru môže akceptovať elektróny negatívnych druhov (nukleofilné). Anhydrid je silné oxidačné činidlo, ktoré znižuje anióny chloridov (CL-).
V prípade NACLO · 5H2Alebo sa predpokladá, že molekuly vody čiastočne bránia CLO- Trpia nukleofilnými útokmi.
Vzhľadom na štrukturálnu linearita CLO-, Tieto molekuly vody nespomalujú dostatočne „útoky“ na atóm CL. Z tohto dôvodu je chlórnan sodný silným oxidačným činidlom.
Odkazy
- Wikipedia. (2018). Chlórnan sodný. Získané 7. apríla 2018, od: In.Wikipedia.orgán
- Francisco J. Arnaiz. (2016). Pokusy pre laboratórium zelenej anorganickej chémie. Katedra chémie, University of Burgos, Španielsko.
- Chemická kniha. (2017). Chlórnan sodný. Získané 7. apríla 2018, od: Chemicalbook.com
- Brian Clegg. (9. marca 2016). Chlórnan sodný. Získané 7. apríla 2018, od: Chemistryworld.com
- Oxychem. (December 2014). Príručka s sodným. Získané 7. apríla 2018, od: Oxy.com
- Publikácia. (2018). Chlórnan sodný. Získané 7. apríla 2018, od: Pubchem.Ncbi.NLM.NIH.Vláda.

