Štruktúra, vlastnosti, použitia, riziká, riziká niklu hydroxidu (III)
- 4108
- 310
- Ing. Ervín Petruška
On Hydroxid niklu (III) Je to anorganická zlúčenina, kde kov niklu má oxidačné číslo 3+. Jeho chemický vzorec je ni (OH)3. Podľa konzultovaných zdrojov doteraz nebolo možné overiť existenciu hydroxidu niklu (III) alebo (OH)3, Ale nikel oxo-hydroxid (III), dieťa (OH).
Nikel (iii) NIO (OH) oxohydroxid je čierna kryštalická tuhá látka, ktorá kryštalizuje dvoma spôsobmi: beta tvar a gama. Najbežnejšou kryštalickou formou (OH) je beta beta.
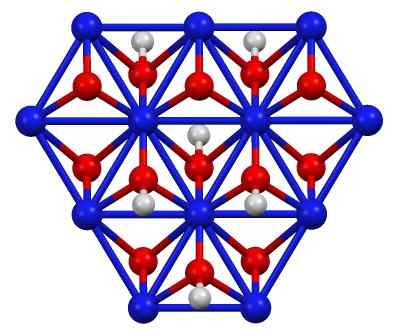
 Štruktúra niklového oxohydroxidu (III), dieťa (OH). Modrý = nikel, červený = kyslík, biely = vodík. Autor: Smokefoot. Zdroj: Vlastná práca. Zdroj: Wikipedia Commons
Štruktúra niklového oxohydroxidu (III), dieťa (OH). Modrý = nikel, červený = kyslík, biely = vodík. Autor: Smokefoot. Zdroj: Vlastná práca. Zdroj: Wikipedia Commons Dieťa (OH) sa dá získať oxidačným roztokom dusičnanu niklu (II) (alebo (nie3)2) s chlórom (Cl2) alebo bróm (bróm2) V prítomnosti hydroxidu draselného (KOH). Nikel (III) oxohydroxid je veľmi rozpustný v kyselinách. Má aplikáciu v niklových batériách v Superca.
Nikel (iii) nio (OH) a hydroxid niklu (ii) alebo (OH) (OH)2 Sú zjednotení pri prevádzke väčšiny svojich aplikácií, pretože obe sú súčasťou rovnakej rovnice oxidu redukcie.
Ako niklová zlúčenina, dieťa (OH) predstavuje rovnaké riziká iných niklových solí, tj podráždenia kože alebo dermatitídy a rakovina.
[TOC]
Kryštalická štruktúra
Nikel oxohydroxid (III) kryštalizuje dvoma spôsobmi: beta a gama. Forma beta β-NIO (OH) má štruktúru veľmi podobnú ako p-ni (OH)2, čo sa zdá byť logické, pretože prvý pochádza z oxidácie jeho druhej.
Forma y-Nio (OH) gama je oxidačný produkt hydroxidu niklu (II) vo svojej alfa, a-Ni (OH) forme2. Rovnako ako posledne menované, Gama má štruktúru vrstvy s alkalickými kovovými iónmi, aniónmi a vodou rozptýlenou medzi vrstvami.
Elektronická konfigurácia
U dieťaťa (OH) sa nikel nachádza v oxidačnom stave 3+, čo znamená, že 3 elektróny chýbajú vo vonkajších vrstvách, to znamená, že dva elektróny vrstvy 4 chýbajúsiež a elektrón z vrstvy 3d. Elektronická konfigurácia ni3+ U dieťaťa (OH) je: [ar] 3d7, Kde [AR] je elektronická konfigurácia plynu Noble Argon.
Môže vám slúžiť: PI odkazMenovanie
- NIO (OH): nikel oxohydroxid (III)
- Nikel čierny
Vlastnosti
Fyzický stav
Čierna kryštalická tuhá látka.
Rozpustnosť
Oxohydroxid NIO (OH) je v kyselinách veľmi rozpustný. Gama fáza sa rozpustí v kyseline sírovej s vývojom kyslíka.
Ďalšie vlastnosti
V horúcej vode sa stáva oxohydroxidom niklu (ii) a (iii), alebo3Ani2(Oh)4.
Rozkladá sa na 140 ° C v nikle (II) (oxid dieťaťa a kyslíka.
Gama fáza (y-Nio (OH)) sa dá získať niekoľkými spôsobmi, napríklad ošetrenie niklu roztavenou zmesou peroxidu sodného (NA2Ani2) a hydroxid sodný (NaOH) pri 600 ° C a chladenie v ľadovej vode.
Gama fáza sa rozpadne, keď sa zahrieva na 138 ° C.
Žiadosti
V niklových batériách
Edisonova batéria niklu-hydrum, v ktorej sa KOH používa ako elektrolyt, je založená na reakcii niklu oxohydroxidu (III) so železom:
Stiahnuť ▼:
Fe + 2nio (OH) + h2Alebo ⇔ viera (oh)2 + 2ni (oh)2
Bremeno:
Je to reverzibilná reakcia na redukciu oxidu.
V anóde týchto batérií sa vyskytuje séria chemických a elektrochemických procesov. Nižšie je všeobecná schéma:
Stiahnuť ▼
β-ni (OH)2 ⇔ β-nio (OH) + h+ + a-
Bremeno
Starnutie ↑ ↓ preťaženie
Stiahnuť ▼
a-ni (OH)2 ⇔ y-nio (OH) + h+ + a-
Bremeno
Môže vám slúžiť: arzén: História, štruktúra, vlastnosti, použitiaV technológii niklovej batérie sa nikel oxohydroxid (III) NIO (OH) nazýva „niklová aktívna hmota“.
 Nabíjateľné batérie. Autor: superusergenerický. Zdroj: Vlastná práca. Zdroj: Wikipedia Commons.
Nabíjateľné batérie. Autor: superusergenerický. Zdroj: Vlastná práca. Zdroj: Wikipedia Commons. Pri elektrokatalýze ako regenerovateľného katalyzátora
Dieťa (OH) sa úspešne používalo v elektrosyntéze azopirazolov, prostredníctvom elektrokatalitickej oxidácie aminopyrazolov. Jej užitočnosť v syntéze karboxylových kyselín začínajúca s alkoholmi alebo karbonylovými zlúčeninami sa tiež dokázala.
 Získanie kyseliny karboxylovej oxidáciou alkoholu katalyzovaného dieťaťom (OH). Zdroj: pôvodne od in.Wikipedia. Pôvodný autor Uploader bol v8rik na in.Wikipedia. Zdroj: Wikipedia Commons
Získanie kyseliny karboxylovej oxidáciou alkoholu katalyzovaného dieťaťom (OH). Zdroj: pôvodne od in.Wikipedia. Pôvodný autor Uploader bol v8rik na in.Wikipedia. Zdroj: Wikipedia Commons Ďalším príkladom je konverzia kvantitatívnej konverzie hydroxymetypyridínu na kyselinu pyridokarboxylovú kyselinu. V tomto prípade je oceľová alebo niklová elektróda zodpovedajúca anóde pokrytá vrstvou dieťaťa (OH). Médium, v ktorom sa vykonáva elektrolýza, je zásadité.
V týchto reakciách dieťa (OH) pôsobí ako sprostredkovateľ redukcie a „redox“.
Elektrolýza sa vykonáva v bunke s niklovou anódou a titánovou katódou v alkalickom médiu. Počas tohto procesu sa vytvorí alebo (OH)2 Na povrchu niklovej anódy, ktorá je rýchlo oxidovaná na dieťa (OH):
Ni (oh)2 + Oh- - a- ⇔ nio (oh) + h2Ani
Dieťa (OH) reaguje s organickým substrátom a získa sa požadovaný organický produkt, ktorý regeneruje Ni (OH)2:
NIO (OH) + Organická zlúčenina → Ni (OH)2 + produkt
Keď sa Ni (OH) regeneruje2, Katalyzačná reakcia pokračuje.
Použitie dieťaťa (OH) ako elektrokatizátora umožňuje získať organické zlúčeniny s nízkymi nákladmi a ekologicky šetrným spôsobom.
V Super CardPisors
Dieťa (OH) spolu s Ni (OH)2 Predstavujú vynikajúce materiály pre elektródy v oblasti supercaidingu (angličtina Supercapacitos).
Ni (oh)2 + Oh- ⇔ nio (oh) + h2Alebo + e-
Majú vysokú kapacitu, nízke náklady a podľa niektorých odkazov pod vplyvom na životné prostredie.
 Kondenzátory v elektronickom obvode. Autor: pdphotos. Zdroj: Pixabay.
Kondenzátory v elektronickom obvode. Autor: pdphotos. Zdroj: Pixabay. Majú však nízku vodivosť. Vyrieši sa pomocou nanočastíc uvedených zlúčenín, pretože teda zvyšuje plochu povrchu a znižuje vzdialenosť potrebnú pre difúziu, ktorá zaisťuje vysokú rýchlosť prenosu elektrónov a/alebo iónov.
Môže vám slúžiť: elastické materiályPri oxidácii kovových iónov
Jedna z komerčných aplikácií niklového oxohydroxidu (III) je založená na jeho schopnosti oxidovať kobaltové ióny (II) v roztoku kobaltových iónov (III).
Riziká
V roztoku je nikel stabilnejší ako ión alebo2+, Preto nie je obvyklé prísť do kontaktu s NI3+. Preventívne opatrenia sú však rovnaké, pretože nikel, či už kovový, vo roztoku alebo vo forme jeho tuhých solí, môže spôsobiť senzibilizáciu kože.
Je vhodné používať ochranné vybavenie a odevy, ako je štít tváre, rukavice a bezpečnostná obuv. To všetko sa musí používať zakaždým, keď existuje možnosť prísť do kontaktu s nikelovými riešeniami.
Ak dôjde k dermatitíde, malo by sa liečiť lekárom, aby sa vylúčilo, že je spôsobená nikel.
Pokiaľ ide o možnosť vdýchnutia, je to osvedčená prax.
Všetky zlúčeniny niklu sú klasifikované Medzinárodnou agentúrou pre výskum rakoviny alebo IARC (skratka pre angličtinu Medzinárodná agentúra pre výskum rakoviny), v kategórii karcinogénov pre človeka.
Je to založené na epidemiologických a experimentálnych údajoch.
Odkazy
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Lyalin, B.Vložka. a kol. Elektrosyntéza azopyrazolov oxidáciou N-alkylaminopyrazolov na anóde dieťaťa (OH) vo vodnej alkali-a zelenej metóde pre N-N Homocouple. Tetramedronové písmená. 59 (2018) 2741-2744. Zotavené z vedeckých pracovníkov.com.
- Liuyang, Zhang a kol. (2018). Materiály na báze niklu pre supercapacitos. Materiály dnes. Zotavené z vedeckých pracovníkov.com
- Ettel, v.Do. a Mosolu, m. Do. (1977). Príprava niklu čiernej. Alebo.Siež. Patent. 4 006 216. 1. februára 1977.
- Scharbert, B. (1993). Proces oxidácie hydroxymetylpyridínových derivátov na deriváty kyseliny pyridinekarboxylovej pri anóde hydroxidu niklu. Alebo.Siež. Patent. 5 259 933. 9. novembra 1993.
- Kirk-Othmer (1994). Encyklopédia chemickej technológie. Zväzok 17. Štvrté vydanie. John Wiley & Sons.
- Ullmannova encyklopédia priemyselnej chémie. (1990). Piaty vydanie. Objem pri 17. VCH Verlagsgellschaft MBH.
- McBreen, James. (1997). Niklové hydroxidy. V príručke materiálov batérií. Vydavateľ VCH. Uzdravený z Ostti.Vláda.
- « História makrokomputerov, charakteristiky, použitia, príklady
- Vydané analógové počítače, komponenty, typy »

