Štruktúra hydroxidu horčíka, vlastnosti, nomenklatúra, použitie

- 2603
- 150
- Václav Višňovský
On hydroxid horečnatý Je to anorganická zlúčenina, ktorej chemický vzorec je mg (OH)2. Vo svojej čistej podobe je to biela pevná látka bez jasu a amorfného vzhľadu; Avšak s malým a presným obsahom nečistôt sa transformuje na kryštalickú pevnú brucitu, minerál, ktorý má v určitých depozitoch v prírode a je bohatým zdrojom horčíka.
Je to slabý elektrolyt alebo báza, takže jeho disociácia je nízka vo vode. Táto vlastnosť vytvára MG (OH)2 dobrý neutralizátor kyslosti pre ľudskú spotrebu; populárne známy liek ako suspenzia mlieka z magnézie. Je to tiež spomaľovač horenia uvoľňovaním vody počas jej tepelného rozkladu.
 Vzorka hydroxidu s pevným horčíkom. Zdroj: Chemical Intert [Public Domain]
Vzorka hydroxidu s pevným horčíkom. Zdroj: Chemical Intert [Public Domain] Na hornom obrázku sú znázornené niektoré tuhé látky hydroxidu horečnatého, v ktorom je možné vidieť jeho nepriehľadnú bielu farbu. Čím viac kryštalickejšie sú, vyvíjajú sa sklovité a perlové povrchy.
Jeho kryštalická štruktúra je zvláštna, pretože zakladá šesťuholníkové kryštály s dvojitým hráčom, ktoré sú sľubnými návrhmi pre návrh nových materiálov. V týchto vrstvách zohrávajú ich pozitívne zaťaženie dôležitou úlohou v dôsledku výmeny MG2+ Trivalentnými katiónmi a druhmi obmedzenými medzi stenami zloženými z aniónov OH-.
Na druhej strane, ďalšie aplikácie sa odvodzujú v závislosti od morfológie pripravených častíc alebo nanočastíc; ako katalyzátory alebo adsorbenty. Vo všetkých z nich je pomer 1: 2 pre mg ióny konštantný2+: Oh-, odráža sa v rovnakom mg vzorec (OH)2.
[TOC]
Štruktúra
Vzorec a oktaedro
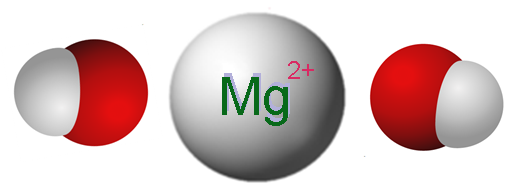 Ióny, ktoré tvoria horčík hydroxid. Zdroj: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Ióny, ktoré tvoria horčík hydroxid. Zdroj: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Vynikajúci obrázok zobrazuje ióny, ktoré tvoria MG (OH)2. Ako je vidieť, existujú dva anióny Och- Pre každú katión mg2+, ktorý interaguje elektrostaticky na definovanie kryštálu hexagonálnej štruktúry. Rovnaký vzorec naznačuje, že pomer mg: OH je 1: 2.
Skutočná kryštalická štruktúra je však o niečo zložitejšia ako predpokladanie jednoduchých iónov MG2+ a oh-. V skutočnosti je horčík charakterizovaný koordinačným počtom 6, takže môže interagovať s až šiestimi oh-.
Vytvára sa teda oktaedron MG (OH)6, kde atómy kyslíka zjavne pochádzajú z OH-; a kryštalická štruktúra teraz spočíva na zvážení takejto oktaedry a na to, ako vzájomne pôsobia.
V skutočnosti jednotky mg (OH)6 Nakoniec definujú štruktúry dvojitých hodiniek, ktoré sú zase objednané vo vesmíre, aby spôsobili šesťuholníkové sklo.
Môže vám slúžiť: atómová váhaDvojitá vrstva
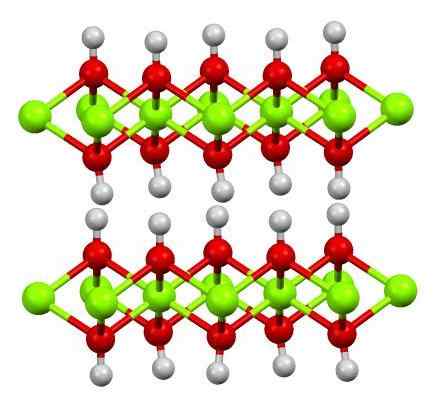 Dvojvrstvová vrstva hydroxidu horčíka. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)]
Dvojvrstvová vrstva hydroxidu horčíka. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Horný obrázok zobrazuje dvojvrstvovú vrstvu hydroxidu horčíka (LDH) Vrstvené dvojité hydroxidy). Zelené gule predstavujú mg ióny2+, ktoré by mohli byť nahradené iným väčším zaťažením, aby sa vytvorilo kladné zaťaženie vo vrstve.
Všimnite si, že okolo každého mg2+ Existuje šesť červených guľôčok spojených s ich príslušnými bielymi guľami; To znamená, že oktaedrické jednotky mg (OH)6. Oh- Pôsobí ako most, aby sa pripojil k dvom mg2+ rôznych lietadiel, vďaka čomu sú vrstvy obmedzené.
Podobne sa pozoruje, že atómy vodíka smerujú nahor a nadol a sú prvými zodpovednými za intermolekulárne sily, ktoré udržujú dve vrstvy jednotiek Mg (OH) pohromade6.
Medzi týmito vrstvami, neutrálne molekuly (ako sú alkoholy, amoniak a dusík) alebo dokonca anióny, v závislosti od toho, aké sú pozitívne (ak existujú ióny3+ alebo viera3+ výmena mg2+). „Výplň“ týchto druhov je obmedzená povrchmi zloženými z aniónov OH-.
Morfológia
Hexagonálne a dvojvrstvové sklo rastie pomaly alebo rýchlo. Všetko záleží na parametroch syntézy alebo prípravy: teplota, molárny vzťah, miešanie, rozpúšťadlá, činidlá ako zdroj horčíka, báz alebo zrážajúcich sa činidiel atď. Ako sklo rastie, definujte mikroštruktúru alebo morfológiu jej nanočastíc alebo agregátov.
Tieto nanočastice teda môžu mať riady, krvné doštičky alebo karfiol. Podobne sa môže zmeniť distribúcia jeho veľkostí, ako aj stupeň pórovitosti výsledných tuhých látok.
Vlastnosti
Fyzický vzhľad
Je to biela, granulovaná alebo prášková pevná látka a toaleta.
Molárna hmota
58,3197 g/mol.
Hustota
3,47 g/ml.
Bod topenia
350 ° C. Pri tejto teplote sa rozpadá v oxidu uvoľnením molekúl vody obsiahnutých v ich kryštáloch:
Mg (oh)2(s) => mgo (s) +h2O (g)
Rozpustnosť
0,004 g/100 ml pri 100 ° C; To znamená, že sotva dokáže rozpustiť vo vriacej vode, takže je to nerozpustná zlúčenina vo vode. Avšak znížením pH (alebo zvýšenej kyslosti) jeho rozpustnosť sa zvyšuje tvorbou komplexného ACUO, MG (OH2)6.
Na druhej strane, ak mg (OH)2 absorboval CO2, uvoľní plyn zachovaný ako šumivo pri rozpustení v kyslom médiu.
Môže vám slúžiť: hélium: História, vlastnosti, štruktúra, riziká, použitiaIndex lomu
1 559
pH
Vodná suspenzia má pH, ktoré sa pohybuje medzi 9,5 a 10,5. Aj keď sú tieto hodnoty normálne, odráža svoju malú základnosť proti iným kovovým hydroxidom (napríklad NaOH).
Tepelná kapacita
77.03 j/mol · k
Kde sa to nachádza?
 Blue Brucita Blue Blut. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)]
Blue Brucita Blue Blut. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0 [CC By-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)] Hydroxid horčíka sa nachádza v prírode ako minerál Brucita, ktorý sa vyznačuje priehľadnou biela farbou, so zelenými alebo modrými tónmi v závislosti od jej nečistôt. Podobne je brucita súčasťou niektorých ílov, ako je chlorit, keď sa rozptýli medzi vrstvami kremičitanov, ktoré sú spojené kovovými iónmi.
V La Brucita existujú aj ďalšie ióny okrem mg2+, ako Al3+, Vernosť3+, Zn2+ a MN2+. Ich MenA sa nachádzajú v rôznych regiónoch alebo jazerách Škótska, Kanady, Talianska a USA.
Fyzicky ich kryštály vidia.
Tento minerál je jedným zo zlých, ktoré ovplyvňujú cementy a betón, pretože má tendenciu expandovať a spôsobovať zlomeniny v nich. Avšak neabsorbuje CO2, Jeho kalcinácia teda neprispieva k skleníkovému účinku, a preto je vhodným mineralogickým zdrojom (a najbohatším) na získanie horčíka, okrem morskej vody, okrem morskej vody.
Menovanie
Mg (oh)2 Má až tri mená akceptované IUPAC (z mineralogie alebo medicíny). Sú veľmi podobné navzájom, pretože rovnako ako spôsob, akým končia.
Napríklad „hydroxid horčík“ zodpovedá jeho názvu podľa nomenklatúry zásob, ktorý nakoniec vynechá (ii), pretože +2 je v predvolenom nastavení takmer jediný stav oxidácie horčíka.
„Dihydroxid horčíka“, smerujúci gréckym čitateľom predponou počtu OH iónov- naznačené vo vzorci podľa systematickej nomenklatúry. A „magnetický hydroxid“, končí príponou -ICO za to, že je maximálny a „jedinečný“ stav oxidácie horčíka, podľa tradičnej nomenklatúry.
Ostatné názvy, ako napríklad brucita alebo magnézia mlieka, hoci sú priamo spojené s touto zlúčeninou, nie je vhodné odkazovať na ňu, pokiaľ ide o jeho najčistejšiu tuhú látku alebo ako anorganickú zlúčeninu (činidlo, surovina atď.).
Žiadosti
Neutralizátor
Mg (oh)2 Vzhľadom na svoju nízku rozpustnosť vo vode skutočnosť, že ide o vynikajúci neutralizátor kyslosti; V opačnom prípade by médium založilo pri prispievaní veľkých koncentrácií OH iónov-, ako to robia iné základne (silné elektrolyty).
Môže vám slúžiť: chemická hybridizáciaMg (OH)2 Sotva uvoľnite OH-, Zároveň reaguje s H iónmi3Ani+ Na vytvorenie komplexu horčíka, tiež uvedený vyššie. Byť schopný neutralizovať kyslosť vodných médií, je určený na liečbu odpadovej vody.
Je to tiež prísada potravín, hnojív a určitých osobných hygienických výrobkov, ako je zubná pasta, pretože jej kyslosť klesá.
Antacidový
Keďže je malý vo vode rozpustný, môže sa brať bez toho, aby sa riskovalo riziko účinkov jeho OH iónov- (veľmi málo disociuje ako slabý elektrolyt).
Táto charakteristika spojená s podčasťou zhora zhora robí z neho antacid na liečbu žalúdka kyslosť, gastrointestinálne choroby, trávenie a zápcha, predávané pod vzorcom magnéziového mlieka.
Na druhej strane, mlieko z Magnézie tiež pomáha bojovať proti nepríjemným fakultám (biele a sčervenané vredy, ktoré sa objavujú v ústach).
Spomaľovač horenia
V časti Vlastnosti sa uvádza, že MG (OH)2 Rozkladá uvoľňovanie vody. Presne, takáto voda pomáha zastaviť pokrok plameňov, pretože absorbujú teplo na odparovanie, a naopak výpary zriedia horľavé alebo horľavé plyny.
Minerál Brucita sa zvyčajne používa priemyselne na tento účel, určený ako vyplnenie určitých materiálov, ako sú plasty rôznych polymérov (PVC, živice, gumy), káblov alebo stropov.
Katalyzátor
Mg (oh)2 Syntetizované ako nanoplaquety sa ukázali ako účinné na katalyzovanie chemických redukcií; Napríklad 4-nitrofenol (pH-no2) 4-aminofenol (pH-NH2). Majú tiež antibakteriálnu aktivitu, takže by sa mohla použiť ako terapeutické činidlo.
Adsorbent
Niektoré mg (OH) pevné látky2 Môžu byť dosť pórovité, v závislosti od metódy ich prípravy. Preto považujú aplikáciu ako adsorbenty.
Vo vodných roztokoch môžu adsorbovať (na svojich povrchoch) sfarbenie molekúl, čím sa čistí voda. Napríklad sú schopní adsorbovať indigové karmínové farbivo prítomné vo vodných prúdoch.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Wikipedia. (2019). Horčík hydroxidu. Zdroj: In.Wikipedia.orgán
- Národné centrum pre biotechnologické informácie. (2019). Horčík hydroxidu. Databáza pubchem. CID = 14791. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Galérie ametyst. (2014). Minerálny brucit. Získané z: galérií.com
- Henrist a kol. (2003). Morfologická štúdia nanočastíc hydroxidu horčíka
- Vyrážané vo zriedenom vodnom roztoku. Journal of Crystal Growth 249, 321-330.
- Saba j., Shanza R. Klimatizovať., Mohamed r. Siež. (2018). Syntéza a štrukturálna analýza mezoporéznych nanočastíc hydroxidu horčíka ako účinného katalyzátora.
- Thimmasandra Narayan Ramesh a Vani Pavada Sreenivasa. (2015). Odstránenie indigového karmínového farbiva z vodného roztoku s použitím hydroxidu horčíka ako adsorbenta. Journal of Materials, zv. 2015, ID článku 753057, 10 strán. doi.org/10.1155/2015/753057
- « História niklu, vlastnosti, štruktúra, použitie, riziká
- Biografia komory Carlos Pellicer, štýl, diela, frázy »

