Lítiová hydridová štruktúra, vlastnosti, získanie, použitia
- 2870
- 891
- Ing. Ervín Petruška
On Hydrid lítium Je to kryštalická anorganická tuhá látka, ktorej chemický vzorec je lih. Je to najľahšia anorganická soľ, jej molekulová hmotnosť je iba 8 g/mol. Je tvorená spojením lítium iónov Li+ a hydrid h ión-. Obaja sú zjednotení iónovým zväzkom.
Lih má vysoký bod topenia. Ľahko reaguje s vodou a pri reakcii, dochádza k vodíkovému plynu. Môže sa získať reakciou medzi roztaveným lítium kovom a plynným vodíkom. Všeobecne sa používa v chemických reakciách na získanie ďalších hydrorov.
 Littium Hydrid, lih. Nie je k dispozícii žiadny strojovo čitateľný autor. Jiago predpokladal (na základe nárokov na autorské práva). [Verejná doména]. Zdroj: Wikimedia Commons.
Littium Hydrid, lih. Nie je k dispozícii žiadny strojovo čitateľný autor. Jiago predpokladal (na základe nárokov na autorské práva). [Verejná doména]. Zdroj: Wikimedia Commons. LIH sa používa na ochranu pred nebezpečným žiarením, ako je žiarenie, ktoré sa nachádzajú v jadrových reaktoroch, sú to, alfa, beta, gama žiarenie, protóny, x -rys a neutróny.
Bola tiež navrhnutá na ochranu materiálov vesmírnych rakiet pohybujúcich sa jadrovým tepelným pohonom. Štúdie sa dokonca používajú ako ochrana ľudskej bytosti pred kozmickým žiarením počas budúcich výletov na planétu Mars.
[TOC]
Štruktúra
V hydride lítium má vodík negatívne zaťaženie h-, No, elektrón ukradol kov, ktorý je vo forme iónu li+.
Elektronická konfigurácia katiónov Li+ Je to: [on] 1s2 čo je veľmi stabilné. A elektronická štruktúra hydridu h- Je: 1s2, čo je tiež veľmi stabilné.
Katión a anión sa viažu elektrostatickými silami.
Hydridný kryštál lítia má rovnakú štruktúru ako chlorid sodný, to znamená kubická kryštalická štruktúra.
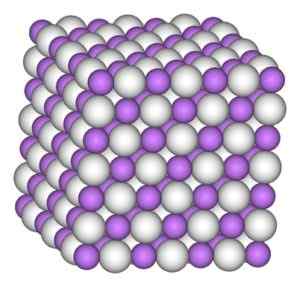 Kubická kryštalická štruktúra hydridu lítia. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Kubická kryštalická štruktúra hydridu lítia. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Menovanie
- Hydrid lítium
- Lih
Vlastnosti
Fyzický stav
Biela alebo bezfarebná kryštalická pevná látka. Komerčné lih môže byť sivou modrou kvôli prítomnosti malých množstiev lítiaho kovu.
Molekulová hmotnosť
8 g/mol
Bod topenia
688 ° C
Bod varu
Rozkladá sa pri 850 ° C.
Teplota
200 ° C
Hustota
0,78 g/cm3
Rozpustnosť
Reagovať vodou. Je nerozpustný v éteroch a uhľovodíkoch.
Ďalšie vlastnosti
Hydrid lítium je oveľa stabilnejší ako hydros ostatných alkalických kovov a môže byť roztavený bez rozkladu.
Môže vám slúžiť: suchú batériuNie je ovplyvnený kyslíkom, ak sa zahrieva pri teplotách pod červenou farbou. Nie je to ovplyvnené ani chlór CL2 a kyselina HCL hydrochlorovodíková.
LIH kontakt s teplom a vlhkosťou spôsobuje exotermickú reakciu (generuje teplo) a vývoj vodíka H2 a hydroxid lítium lioh.
Môže tvoriť jemný prach, ktorý sa môže využívať v kontakte s plameňmi, teplom alebo oxidačnými materiálmi. Nemali by ste kontaktovať oxid dusný alebo kvapalný kyslík, pretože môže využívať alebo zapnúť.
Smaví sa tým, že je vystavený svetlu.
Získanie
Hydrid lítium sa získal v laboratóriu reakciou medzi roztaveným kovom lítium a plynným vodíkom pri teplote 973 K (700 ° C).
2 li + h2 → 2 lih
Dobré výsledky sa získajú, keď sa zvýši exponovaný povrch roztaveného lítia a keď sa skráti čas sedimentácie LIH. Je to exotermická reakcia.
Používam ako ochranný štít pred nebezpečným žiarením
LIH predstavuje sériu charakteristík, vďaka ktorým je atraktívna na použitie ako ochrana ľudskej bytosti v jadrových reaktoroch a vesmírnych systémoch. Tu sú niektoré z týchto charakteristík:
- Má vysoký obsah vodíka (12,68 % hmotnosti h) a vysoký počet atómov vodíka na jednotku objemu (5,85 x 1022 H/cm atómy3).
- Jeho vysoký bod topenia umožňuje jeho používanie vo vysokoteplotných prostrediach bez toho, aby bol založený.
- Má nízky disociačný tlak (~ 20 Torr v jeho teplote topenia), ktorý umožňuje odlievanie a zmrazenie materiálu bez degradovania pri nízkom tlaku vodíka.
- Má nízku hustotu, vďaka ktorej je atraktívna na použitie v vesmírnych systémoch.
- Ich nevýhody sú však ich nízkou tepelnou vodivosťou a zlými mechanickými vlastnosťami. To však neznižovalo jeho uplatniteľnosť.
- Kusy LIH, ktoré slúžia ako štíty, sa vyrábajú studeným alebo horúcim lisovaním a fúziou a nalievaním do foriem. Aj keď je uprednostňovaný tento posledný formulár.
- Pri teplote miestnosti sú časti chránené pred vodou a vodnou parou.
- V jadrových reaktoroch
V jadrových reaktoroch existujú dva typy žiarenia:
Môže vám slúžiť: kyseliny a základne v každodennom živote: reakcie, použitia, príkladyPriame ionizujúce žiarenie
Sú to vysoko energetické častice, ktoré nesú elektrický náboj, ako napríklad alfa (a) a beta (β) a protóny častíc. Tieto typy žiarenia veľmi silne interagujú s materiálmi štítov, čo spôsobuje ionizáciu pri interakcii s elektrónmi materiálov materiálov, cez ktoré prechádzajú.
Nepriamo ionizujúce žiarenie
Sú to neutróny, gama lúče (γ) a X -Rays, ktoré prenikajú a vyžadujú ochranu hmotnosti, pretože zahŕňajú emisie zaťažených sekundárnych častíc, ktoré sú tie, ktoré spôsobujú ionizáciu.
 Symbol varovať pred nebezpečným žiarením. IAEA & ISO [verejná doména]. Zdroj: Wikimedia Commons.
Symbol varovať pred nebezpečným žiarením. IAEA & ISO [verejná doména]. Zdroj: Wikimedia Commons. Podľa niektorých zdrojov je LIH účinný pri ochrane materiálov a ľudí pred týmito typmi žiarenia.
- V jadrových systémoch tepelného pohonu
LIH bol nedávno vybraný ako potenciálny moderátor a ochranný materiál proti jadrovému žiareniu pre jadrové tepelné pohonné systémy kozmickej lode na veľmi dlhú cestu.
 Umelecké znázornenie vesmírneho vozidla s jadrovým pohonom na obežnej dráhe Mars. NASA/SAIC/PAT RAWLINGS [verejná doména]. Zdroj: Wikimedia Commons.
Umelecké znázornenie vesmírneho vozidla s jadrovým pohonom na obežnej dráhe Mars. NASA/SAIC/PAT RAWLINGS [verejná doména]. Zdroj: Wikimedia Commons. Jeho nízka hustota a vysoký obsah vodíka spôsobujú, že hmotnosť a objem jadrového pohonného reaktora účinne zníži.
- V ochrane pred kozmickým žiarením
Vystavenie vesmírnemu žiareniu je najdôležitejšie riziko ľudského zdravia v budúcich medziplanetárnych prieskumných misiách.
V hlbokom priestore budú astronauti vystavení úplnému spektru galaktických kozmických lúčov (ióny s vysokou energiou) a ejekčné udalosti slnečných častíc (protóny).
Nebezpečenstvo expozície žiarenia je zhoršené v dôsledku trvania misií. Okrem toho je potrebné zvážiť aj ochranu miest, ktoré musia zvážiť prieskumníci.
 Budúca simulácia biotopu na planéte Mars. NASA [verejná doména]. Zdroj: Wikimedia Commons.
Budúca simulácia biotopu na planéte Mars. NASA [verejná doména]. Zdroj: Wikimedia Commons. V tomto poradí nápadov štúdia uskutočnená v roku 2018 naznačila, že medzi osvedčenými materiálmi poskytuje LIH najvyššie zníženie žiarenia na gram za cm2, Preto byť jedným z najlepších kandidátov, ktorý sa má použiť na ochranu pred kozmickým žiarením. Tieto štúdie sa však musia prehĺbiť.
Používam ako prostriedok skladovania a bezpečného transportu vodíka
Získanie energie z H2 Je to niečo, čo sa študovalo niekoľko desiatok rokov a už našla aplikáciu na nahradenie fosílnych palív v dopravných vozidlách.
Môže vám slúžiť: Chemická rovnováha: Vysvetlenie, faktory, typy, príkladyH2 Môže sa použiť v palivových článkoch a prispievať k zníženiu ko -produkcie2 a nieX, Tým sa vyhnite skleníkovému efektu a znečisteniu. Efektívny systém skladovania a prepravy H však ešte nebol nájdený2 Určite s ľahkou, kompaktnou alebo malou hmotnosťou, ktorá ju rýchlo vedie a uvoľňuje H2 rovnako rýchly.
LiH lítium hydrid je z alkalických hydrorov, ktoré majú najvyššiu skladovaciu kapacitu H2 (12,7 % hmotnosti h). Vydanie h2 hydrolýzou podľa nasledujúcej reakcie:
LIH + H2O → liOH + h2
LIH dodáva 0,254 kg vodíka pre každý kg lih. Okrem toho má vysokú úložnú kapacitu na jednotku objemu, čo znamená, že je svetlo a je kompaktným médiom pre ukladanie H2.
 Motocykel, ktorého palivo je vodík uložený vo forme kovového hydridu, ako je lih. Alebo.Siež. DOE energeticky účinná a obnoviteľná energia (USA) [verejná doména]. Zdroj: Wikimedia Commons.
Motocykel, ktorého palivo je vodík uložený vo forme kovového hydridu, ako je lih. Alebo.Siež. DOE energeticky účinná a obnoviteľná energia (USA) [verejná doména]. Zdroj: Wikimedia Commons. Okrem toho sa LIH ľahšie vytvára ako iné hydrory alkalických kovov a je chemicky stabilný pri teplotách a tlakoch v prostredí. LIH sa môže prepravovať z výrobcu alebo dodávateľa používateľovi. Potom hydrolýzou LiH sa vytvorí H2 A to sa používa bezpečne.
Vytvorený hydroxid lítium LiOH sa môže vrátiť dodávateľovi, ktorý regeneruje lítium elektrolýzou, a potom sa znova vyrobí lih.
LIH sa tiež úspešne študoval, aby sa použil spolu s tučným hydraccínom na rovnaký účel.
Použitie v chemických reakciách
LIH umožňuje syntézu komplexných hydrorov.
Slúži napríklad na prípravu lítium triedylborohydridu, ktorý je silným nukleofilom v organických reakciách na vytesnenie haluróz.
Odkazy
- Sato a. A Takeda, alebo. (2013). Skladovací a prepravný systém vodíka pomocou lítium hydridu pomocou technológie roztavenej soli. V chémii roztavených soli. Kapitola 22, strany 451-470. Zotavené z vedeckých pracovníkov.com.
- Alebo.Siež. Lekárska knižnica. (2019). Hydrid lítium. Získané z: pubchem.Ncbi.NLM.NIH.Vláda.
- Wang, l. a kol. (2019). Skúmanie vplyvu tematického kernelového účinku hydridu lichia na reaktív jadrovej. Annals of Nuclear Energy 128 (2019) 24-32. Zotavené z vedeckých pracovníkov.com.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Giraudo, m. a kol. (2018). Testy tienenia založené na urýchľovači rôznych materiálov a viacerých výrobkov pomocou vysokoenergetických svetla a ťažkých iónov. Radiačný výskum 190; 526-537 (2018). NCBI sa zotavila.NLM.NIH.Vláda.
- Welch, f.H. (1974). Hydrid lítium: materiál tienenia vesmírneho veku. Jadrové inžinierstvo a dizajn 26, 3, február 1974, strany 444-460. Zotavené z vedeckých pracovníkov.com.
- Simnad, M.Tón.(2001). Jadrové reaktory: tieniace materiály. V encyklopédii materiálov: Science and Technology (druhé vydanie). Strany 6377-6384. Zotavené z vedeckých pracovníkov.com.
- Hügy, T. a kol. (2009). Hydrazínové borane: sľubný materiál na skladovanie vodíka. J. Hod. Chem. SOC. 2009, 131, 7444-7446. Získané z krčiem.ACS.orgán.
- « Amenadiel význam, prítomnosť v Biblii a Lucifer
- História mayskej medicíny, Boh, rastliny, choroby »

