Hydroxiapatit

- 4993
- 1390
- Gabriel Bahna
Vysvetľujeme, čo je hydroxylapatit, jeho štruktúra, spôsob, akým sa syntetizuje, jeho použitie a fyzikálne a chemické vlastnosti
 Hydroxiapatit. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0, CC By-SA 3.0, cez Wikimedia Commons
Hydroxiapatit. Zdroj: Rob Lavinsky, Irocks.com-ccy-SA-3.0, CC By-SA 3.0, cez Wikimedia Commons Čo je hydroxyapatit?
Ten Hydroxiapatit Je to minerál fosforečnanu vápenatého, ktorého chemický vzorec je CA10(PO4)6(Oh)2. Spolu s inými minerálmi a organickými a zhutnenými organickými látkami tvorí surovinu známu ako fosforečná hornina. Termín hydroxi sa vzťahuje na anión OH-.
Keby namiesto tohto aniónu bol fluorid, minerál by sa nazval fluórapatita (CA10(PO4)6(F)2; A tak s inými aniónmi (CL-, Br-, Co32-, atď.). Podobne je hydroxyapatit hlavnou anorganickou zložkou kostí a zubnej smalt.
Takže je to dôležitý prvok v kostných tkanivách živých bytostí. Jeho veľká stabilita voči iným fosfátom vápenatého mu umožňuje podporovať fyziologické podmienky, čo dáva kostom ich charakteristickú tvrdosť. Hydroxiapatit nie je sám: plní svoju funkciu sprevádzaná kolagénom, vláknitý proteín spojivých tkanív.
Hydroxyapatit (alebo hydroxylapatit) obsahuje CA ióny2+, Ale iné katióny môžu tiež ubytovať vo svojej štruktúre (mg2+, Nat+), nečistoty zapojené do iných biochemických procesov kostí (napríklad ich prestavba).
Hydroxyapatitová štruktúra
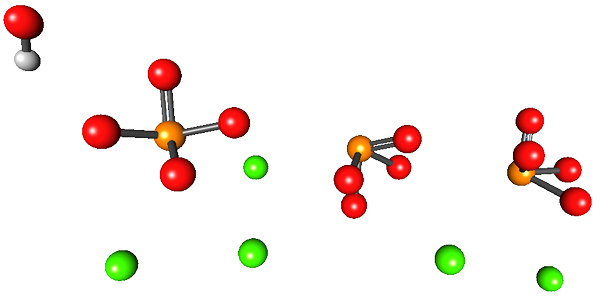
Vynikajúci obrázok ilustruje štruktúru hydroxyapatitu vápenatého. Všetky gule zaberajú objem polovice šesťuholníkovej „zásuvky“, kde druhá polovica je identická s prvou.
V tejto štruktúre zelené gule zodpovedajú katiónom CA2+, Zatiaľ čo červené gule na atómy kyslíka, atómy oranžového až fosforu a biele k atómu vodíka OH-.
Fosfáty iónov na tomto obrázku majú defekt nevykazovania tetraedrálnej geometrie; Namiesto toho sa zdajú byť ako pyramídy štvorcových základných.
Môže vám slúžiť: sklovecOh- vyvoláva dojem, že sa nachádza ďaleko od CA2+. Kryštalická jednotka sa však môže opakovať na streche prvej, a tak ukazuje úzkosť medzi oboma iónmi. Tieto ióny môžu byť tiež nahradené ostatnými (NA+ a f-, Napríklad).
Syntéza hydroxylapatitu
Hydroxylapatit sa môže syntetizovať reakciou hydroxidu vápenatého s kyselinou fosforečnej:
10 CA (OH)2 + 6 h3Po4 => Ca10(PO4)6(Oh)2 + 18 h2Ani
Hydroxiapatita (CA10(PO4)6(Oh)2) je vyjadrená dvoma jednotkami vzorec CA5(PO4)3Oh.
Podobne môže byť hydroxyapatit syntetizovaný nasledujúcou reakciou:
10 CA (nie3)2.4H2O + 6 nh4H2Po4 => Ca10(PO4)6(Oh)2 + 20 NH4Nie3 + 52 h2Ani
Riadenie rýchlosti zrážok umožňuje túto reakciu generovať hydroxyapatitové nanočastice.
Hydroxyapatitové kryštály

Ióny sú zhutnené a rastú, aby tvorili rigidné a rezistentné biokritické. Používa sa ako biomateriál mineralizácie kostí.
Potrebuje však kolagén, organickú podporu, ktorá slúži ako forma jeho rastu. Tieto kryštály a ich komplikované formovacie procesy budú závisieť od kostnej kosti (alebo zubu).
Tieto kryštály rastú impregnované organickými látkami a aplikácia elektronických mikroskopických techník ich podrobne opisuje v zuboch ako agregáty s tvarmi tyčí nazývaných hranoly.
Používa hydroxylapatit
Lekárske a zubné použitie
Kvôli svojej podobnosti vo veľkosti, kryštalografii a zložení s tvrdým ľudským tkanivom je nanohydroxyapatit atraktívny na použitie v protézach. Nanohydroxyapatit je tiež biokompatibilný, bioaktívny a prírodný, okrem toho, že nie je toxický alebo zápalový.
V dôsledku toho má nanohydroxyapatitová keramika rôzne aplikácie, ktoré zahŕňajú:
- Pri chirurgii kostí Tejido sa používa pri plnení dutín v ortopedických, traumatologických, maxilofaciálnych a zubných operáciách.
- Používa sa ako ortopedický a zubný implantát. Je to desenzibilizačné činidlo, ktoré sa používa na bielenie zubov. Používa sa tiež ako remineralizačné činidlo v zubných pastoch a liečbe včasným kazom.
- Implantáty z nehrdzavejúcej ocele a titánu sú často pokryté hydroxyapatitom, aby sa znížila rýchlosť odmietnutia.
- Je to alternatíva k alogénnym a xenogénnym štepom kostí. Čas uzdravenia je kratší v prítomnosti hydroxyapatitu ako v jeho neprítomnosti.
- Nanohidroxyapatit Syntetická mimetizácia s hydroxyapatitom prítomným prirodzene v dentíne a apatitovom enmaltickom, takže jeho použitie pri oprave smaltu a inkorporácie do zubných pastov je výhodné, ako aj v ústach.
Iné použitia hydroxyapatitu
- Hydroxyapatit sa používa vo vzduchových filtroch motorových vozidiel na zvýšenie ich účinnosti absorpcie a rozkladu oxidu uhoľnatého (CO). To znižuje znečistenie životného prostredia.
- Syntetizovaný bol komplex alginátu-hydroxyapatitu, že testy v teréne naznačili, že je schopný absorbovať fluorid prostredníctvom mechanizmu výmeny iónov.
- Hydroxiapatit sa používa ako chromatografické médium pre proteíny. To má pozitívne poplatky (CA++) a negatívne (PO4-3), takže môže interagovať s elektricky nabitými proteínmi a umožniť jeho separáciu výmenou iónov.
- Hydroxyapatit sa tiež používa ako podpora elektrofotických nukleových kyselín. Je možné oddeliť DNA od RNA, ako aj DNA jednoduchého vlákna z dvoch reťazcov DNA.
Fyzikálne a chemické vlastnosti
Hydroxyapatit je biela pevná látka, ktorá dokáže získať sivé, žlté a zelenkavé tóny. Rovnako ako kryštalická tuhá látka, predstavuje vysoké body fúzie, čo svedčí o silných elektrostatických interakciách; Pre hydroxyapatit je to 1100 ° C.
Je hustejšia ako voda s hustotou 3,05 - 3,15 g/cm3. Okrem toho je prakticky nerozpustný vo vode (0,3 mg/ml), čo je spôsobené fosfátovými iónmi.
Avšak v kyslom médiu (ako v HCl) je rozpustný. Táto rozpustnosť je spôsobená tvorbou CACL2, Vysoko rozpustná vodná soľ. Podobne sú fosfáty protón (HPO42- a h2Po4-) a interagovať do lepšieho stupňa s vodou.
Rozpustnosť kyslého hydroxyapatitu je dôležitá v patofyziológii kazu. Baktérie v orálnej dutine Vylučujú kyselinu mliečnu, produkt fermentácie glukózy, ktorá znižuje pH zubného povrchu na menej ako 5, takže hydroxyapatit sa začína rozpúšťať.
Môže vám slúžiť: sublimácia: koncept, proces a príkladyFluorid (f-) Môžete nahradiť OH ióny- V kryštalickej štruktúre. Ak sa to stane, poskytuje odolnosť voči hydroxyapatitu zubnej skloviny pred kyselinami.
Pravdepodobne tento odpor môže byť spôsobený nerozpustnosťou CAF2 vytvorené, odmietajúc „opustiť“ sklo.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie., p. 349, 627). MC Graw Hill.
- Tekutina. (2017). Hydroxylapatit. Zdroj: z tekutiny.com
- Gaiabulbox. (5. novembra 2015). Hydroxyapatit. [Obrázok]. Zotavené z Commons.Wikimedia.orgán
- Martin.Neitsov. (25. novembra 2015). Hüdroksüapatiidi Kristallid. [Obrázok]. Zotavené z Commons.Wikimedia.orgán
- Wikipedia. (2018). Hydroxylapatit. Získaný z.Wikipedia.orgán
- Fiona Petchey. Kosť. C14Dating zotanovil sa.com

