Katalytická hydrogenácia
- 4392
- 819
- Blažej Hrmo
 Katalytická hydrogenácia je chemická reakcia, kde konečným výsledkom je pridanie vodíka do inej zlúčeniny. Zdroj: Gabriel Bolívar
Katalytická hydrogenácia je chemická reakcia, kde konečným výsledkom je pridanie vodíka do inej zlúčeniny. Zdroj: Gabriel Bolívar Čo je katalytická hydrogenácia?
Ten katalytická hydrogenácia Je to chemická reakcia, ktorou sa molekulárny vodík pridáva do zlúčeniny pri vyšších rýchlostiach.
H molekula2 Nielenže musí najprv prelomiť svoju kovalentnú väzbu, ale aj tak, že sú také malé a účinné zrážky medzi ňou a zlúčeninou, kam sa pridá, je menej pravdepodobné.
Zlúčenina vodíkových receptorov môže byť dobre organická alebo anorganická. V organických zlúčeninách sú tam, kde je väčšina príkladov katalytickej hydrogenácie, najmä tie, ktoré majú farmakologickú aktivitu alebo majú kovy začlenené do svojich štruktúr (organometalické zlúčeniny).
Keď sa pridá H2 Do štruktúry plnej uhlíka je to, že jeho nenasýtenie klesá, to znamená, že uhlík dosahuje maximálny stupeň jednoduchých spojení, ktoré môže tvoriť.
Preto h2 Pridajú sa dvojité (c = c) a trojité (C≡C) odkazy, hoci sa dajú pridať aj do skupín karbonílov (C = O).
Alkény a alkíny teda reagujú katalytickou hydrogenáciou. Povrchne analyzujúca akúkoľvek štruktúru, dá sa predpovedať, či bude pridať alebo nie H2 Stačí odhaliť dvojité a trojité odkazy.
Charakteristiky katalytickej hydrogenácie
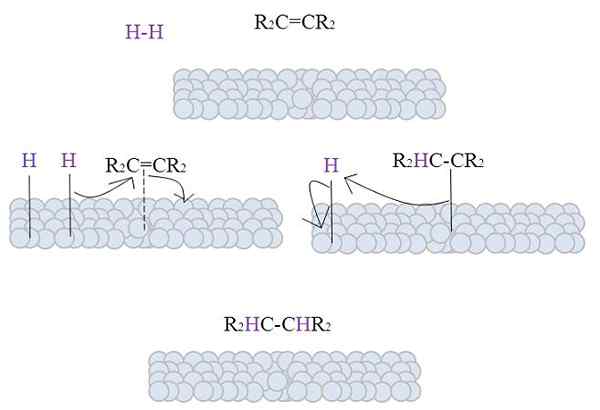
Obrázok ukazuje mechanizmus tejto reakcie. Pred opisom je však potrebné riešiť niektoré teoretické aspekty.
Povrchy sivých guľôčok predstavujú atómy kovov, ktoré, ako bude vidieť, sú katalyzátormi hydrogenácie par excellence.
Prasknutia vodíkovej väzby
- Hydrogenácia je exotermická reakcia, to znamená, že uvoľňuje teplo v dôsledku tvorby zlúčenín s nižšou energiou.
Môže vám slúžiť: acetanylid (C8H9No)- Vytvorené väzby C-H sú stabilné, ktoré vyžadujú väčšiu energiu na neskoršie prasknutie ako H-H väzba molekulárneho vodíka potrieb.
- Hydrogenácia vždy zahŕňa najprv prasknutie spojenia H-H. Toto prasknutie môže byť homolitické, ako v mnohých prípadoch:
H-h => h ∙ + ∙ h
Alebo heterolytické, ktoré je možné podať napríklad, keď je oxid zinočnatého vodíka, ZnO:
H-h => h+ + H-
- Rozdiel medzi týmito dvoma prasknutiami spočíva v tom, ako sa rozdeľujú elektróny spojenia. Ak sú distribuované rovnako (kovalentne), každý H končí zachovaním elektrónu, zatiaľ čo ak je distribúcia iónová, jeden končí bez elektrónov, H+, A druhý ich úplne vyhrá, h-.
- Obe prasknutia sú možné v katalytickej hydrogenácii, hoci homolity umožňuje ustúpiť vývoju logického mechanizmu na to.
Experimentálny
- Vodík je plyn, a preto musí byť temperamentný a zaručuje, že iba on prevláda na povrchu kvapaliny.
- Zlúčenina vodíka musí byť rozpustená v médiu, či už ide o vodu, alkohol, éter, estery alebo tekutý amín. Inak by hydrogenácia prešla veľmi pomaly.
Zlúčenina rozpustila do vodíka, musí existovať aj katalyzátor v reakčnom médiu. To bude zodpovedné za zrýchlenie rýchlosti reakcie.
- Pri katalytickej hydrogenácii sa zvyčajne používajú jemne rozdelené kovy niklu, paladium, platiny alebo rodu, ktoré sú nerozpustné takmer vo všetkých organických rozpúšťadlách. Preto budú existovať dve fázy: kvapalina so rozpustenou zlúčeninou a vodíkom a pevnou látkou katalyzátora.
Môže vám slúžiť: Plavba pre tégliku: Charakteristiky, funkcie, použite príklady- Tieto kovy poskytujú svoj povrch tak, aby reagovali vodík a zlúčenina, takže sa urýchlili zlomy väzieb.
- Znižujú tiež priestor šírenia druhu, čím sa zvyšuje počet účinných molekulárnych kolízií. Nielen to, ale aj reakcia prebieha v póroch kovu.
Typy katalytickej hydrogenácie
Homogénny
Hovorí sa o homogénnej katalytickej hydrogenácii, keď médium reakcie pozostáva z jednej fázy. Tu používanie kovov v ich čistých štátoch, pretože sú nerozpustné.
Namiesto toho sa používajú organometalické zlúčeniny týchto kovov, ktoré sú rozpustné a ukázali sa, že majú vysoké výnosy.
Jednou z týchto organometalických zlúčenín je Wilkinson Catalyst: Tris chlorid (trifenylfín) Rodio, [(C6H5)3P]3Rhcl.
Tieto zlúčeniny tvoria komplex s H2, Aktivovanie pre jeho následný doplnok k alkéne alebo alquino.
Homogénna hydrogenácia predstavuje oveľa viac alternatív ako heterogénne, pretože chémia v organometalických zlúčeninách je hojná: stačí zmeniť kov (PT, PD, RH, NI) a ligandy (organické alebo anorganické molekuly spojené s kovovým centrom) Získajte nový katalyzátor.
Heterogénny
Heterogénna katalytická hydrogenácia, ako je uvedené, má dve fázy: jedna kvapalina a jedna tuhá látka.
Okrem kovových katalyzátorov existujú aj ďalšie, ktoré pozostávajú z pevnej zmesi. Napríklad katalyzátor Lindlar, ktorý sa skladá z platiny, uhličitanu vápenatého, octanu olovo a chinolínom.
Lindlar katalyzátor má zvláštnosť, že je zlá pre hydrogenáciu alkénov. Je však veľmi užitočný pre čiastočné hydrogenácie, to znamená, že funguje vynikajúco na Alkines:
Môže vám slúžiť: Lutecio: Štruktúra, vlastnosti, použitie, získanieRC≡CR + H2 => Rhc = chrt
Mechanizmus
Obrázok ukazuje mechanizmus katalytickej hydrogenácie s použitím práškového kovu ako katalyzátora.
Šedé gule zodpovedajú kovovému povrchu, povedzme, platiny. Molekula h2 (fialová farba) je blízko kovového povrchu, ako aj náhradný tetra alkén, r2C = cr2.
H2 Interakcia s elektrónmi, ktoré cestujú po atómoch kovu, a prerušenie a tvorba časového spojenia H-M, kde m je kov. Tento proces je známy ako chemisorpcia. To znamená adsorpciu chemickými silami.
Alkeén interaguje podobným spôsobom, ale odkaz ho tvorí s jeho dvojitou väzbou (bodkovaná čiara).
H-H väzba sa už disociovala a každý atóm vodíka zostáva spojený s kovom. Podobne to robí s kovovými centrami v organometalických katalyzátoroch, ktoré tvorí sprostredkovateľský komplex H-M-H.
Potom sa vyskytuje migrácia H smerom k dvojitej väzbe, a to sa otvára a vytvára spojenie s kovom. Potom zostávajúci H pripojí k druhému uhlíku z pôvodnej dvojitej väzby a vyrobená alkán je konečne uvoľnená, r2HC-CHR2.
Tento mechanizmus sa bude opakovať toľkokrát, koľkokrát je to potrebné, až do všetkých h2 úplne reagovali.
Odkazy
- Carey, f. (2008). Organická chémia. MC Graw Hill.
- Shiver & Atkins (2008). Anorganická chémia. MC Graw Hill.
- Lew, J. (s.F.). Katalytická hydrogenácia alkénov. Chémia obnovená.Librettexts.orgán
- Čo je katalytická hydrogenácia? - Mechanizmus a reakcia. Zotavená štúdia.com

