Vlastnosti alifatických uhľovodíkov, nomenklatúra, reakcie, typy

- 4948
- 1085
- JUDr. Rudolf Čapkovič
Ten Alifatické uhľovodíky Sú to všetci tí, ktorí nemajú aromaticitu, nie v čuchovom zmysle, ale pokiaľ ide o chemickú stabilitu. Klasifikácia uhľovodíkov týmto spôsobom je dnes príliš nejednoznačná a nepresná, pretože nerozlišuje medzi rôznymi typmi uhľovodíkov, ktoré nie sú aromatické.
Máme teda alifatické uhľovodíky a aromatické uhľovodíky. Ten je uznávaný ich základnou jednotkou: Benncénico Ring. Ostatné môžu na druhej strane prijať akúkoľvek molekulárnu štruktúru: lineárne, rozvetvené, cyklické, nenasýtené, polycyklické; Pokiaľ nemajú konjugované systémy, ako je benzén.
 Kvapalinové palivo zapaľovačov pozostáva zo zmesi alifatických uhľovodíkov. Zdroj: pixnio.
Kvapalinové palivo zapaľovačov pozostáva zo zmesi alifatických uhľovodíkov. Zdroj: pixnio. Termín „alifatický“ sa zrodil z gréckeho slova „Aleiphar“, čo znamená tuk, tiež sa používa na označenie olejov. Preto v devätnástom storočí bola táto klasifikácia priradená uhľovodíkom získaným z mastných extraktov; Zatiaľ čo aromatické uhľovodíky boli extrahované zo stromov a voňavých živicí.
Avšak ako základ konsolidovanej organickej chémie sa zistilo, že existuje chemická vlastnosť, ktorá diferencovala uhľovodíky, ešte dôležitejšie ako ich prírodné zdroje: aromaticita (a nie vôňa).
Týmto spôsobom prestali alifatické uhľovodíky iba tie, ktoré sa získali z tukov, aby boli všetci tí, ktorí nemajú aromaticitu. V rámci tejto rodiny máme alkény a alkíny, bez ohľadu na to, či sú lineárne alebo cyklické. Preto sa „alifatický“ považuje za nepresný; Aj keď je to užitočné pri riešení niektorých všeobecných aspektov.
Napríklad, keď sa hovorí „extrémne“ alebo „reťazce“ alifatické, molekulárne oblasti sa zmieňujú o tom, kde chýbajú aromatické krúžky. Zo všetkých alifatických uhľovodíkov je najjednoduchšou podľa definície metán, cho4; Zatiaľ čo benzén je najjednoduchší aromatický uhľovodíky.
[TOC]
Vlastnosti alifatických uhľovodíkov
Vlastnosti alifatických uhľovodíkov oscilujú v rôznych stupňoch v závislosti od toho, ktoré z nich sa považujú. Existujú nízke a vysoké molekulárne hmoty, ako aj lineárne, rozvetvené, cyklické alebo polycyklické, dokonca aj hladiny úžasných trojrozmerných štruktúr; Rovnako ako u kubánskeho, vo forme kocky.
Existujú však niektoré všeobecné práva, ktoré je možné spomenúť. Väčšina alifatických uhľovodíkov sú hydrofóbne a apolárne plyny alebo kvapaliny, ktoré majú viac apolárnych ako iné, pretože do zoznamu sú zahrnuté aj tie, v ktorých uhlíkové reťazce majú halogén, kyslík, dusík alebo atómy síry.
Môže vám slúžiť: Bór: História, vlastnosti, štruktúra, použitieSú to tiež horľavé zlúčeniny, pretože sú náchylné na oxidáciu vo vzduchu pred minimálnym zdrojom tepla. Táto vlastnosť sa stáva nebezpečnejšou, ak pridáme svoju vysokú volatilitu, kvôli slabým disperzným interakciám, ktoré udržiavajú alifatické molekuly súdržné.
Napríklad to vidíme v butáne, plyne, ktorý sa dá skvapať s relatívnou ľahkosťou, ako aj propánu. Obidve sú veľmi prchavé a horľavé, takže sú aktívnymi komponentmi kuchynského plynu alebo vreckových zapaľovačov.
Takáto volatilita má samozrejme tendenciu klesať, pretože molekulárna hmota a uhľovodík spôsobujú čoraz viac viskóznych kvapalín.
Menovanie
Nomenklatúra uhľovodíkov sa líši ešte viac ako jej vlastnosti. Ak ide o alko alebo alkíny, nasledujú sa rovnaké normy stanovené IUPAC: vyberte najdlhší reťazec, priraďte najnižšie ukazovatele k najviac vymenenému koncu alebo k heteroatómom alebo reaktívnym skupinám.
Týmto spôsobom viete, v ktorom uhlíku sa nachádza každý substituent, alebo dokonca nenasýtenie (dvojité alebo trojité odkazy). V prípade cyklických uhľovodíkov predchádzajú názov substituenty uvedený v abecednom poradí, po ktorom nasleduje slovo „cyklus“, ktorý spočítava čísla uhlíka, ktoré ho integrujú.
Zvážte napríklad nasledujúce dva cyklohexany:
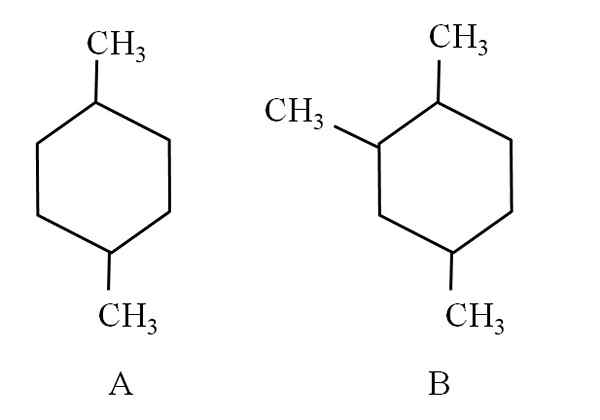 Dva cyklohexany, ktoré sú klasifikované ako alifatické uhľovodíky. Zdroj: Gabriel Bolívar.
Dva cyklohexany, ktoré sú klasifikované ako alifatické uhľovodíky. Zdroj: Gabriel Bolívar. Cyklohexan A, sa nazýva 1,4-dimetylciclonohexan. Keby bol prsteň päť uhlíkov, bolo by to 1,4-dimetylciclopentano. Medzitým sa cyklohexan B nazýva 1,2,4-trimetylcyklohexan a nie 1,4,6-cyklohexan, pretože sa snaží použiť najnižšie ukazovatele.
Teraz sa môže nomenklatúra stať veľmi komplikovanou pre operné štruktúry uhľovodíky. Pre nich existujú konkrétnejšie pravidlá, ktoré treba vysvetliť osobitne a opatrne; Rovnako ako v prípade cieľov, terpénov, politík a polycyklických zlúčenín.
Reakcie
Spaľovanie
Našťastie sú reakcie pre tieto uhľovodíky menej rozmanité. Jeden z nich už bol spomenutý: ľahko spaľujú, produkujú oxid uhličitý a vodu, okrem iných oxidov alebo plynov v závislosti od prítomnosti heteroatómov (CL, N, P, O atď.). CO2 a h2Alebo sú hlavnými výrobkami spaľovania.
Prírastok
Ak majú nenasýtenie, môžu utrpieť sčítanie reakcií; To znamená, že do svojej kostry začleňujú malé molekuly ako substituenty podľa špecifického mechanizmu. Medzi týmito molekulami máme vodu, vodík a halogény (f2, Cl2, Br2 a ja2).
Halogenácia
Na druhej strane, alifatické uhľovodíky pod výskytom ultrafialového žiarenia (HV) a teplo môže prelomiť odkazy na c-.). Toto je halogenačná reakcia, ktorá sa pozoruje vo veľmi krátkodobých alkánoch, ako je metán alebo pentan.
Môže vám slúžiť: Nitrites: Vlastnosti, štruktúra, nomenklatúra, formovanieCraqueo
Ďalšou reakciou, ktorú môžu alifatické uhľovodíky trpieť, najmä alkán s dlhým reťazcom, je tepelné praskanie. Skladá sa z dodávky intenzívneho tepla tak, aby tepelná energia prelomila väzby C-C, a teda aj malé molekuly, ktoré sa na trhu s palivami vytvoria z veľkých molekúl.
Štyri vyššie uvedené reakcie sú hlavné, ktoré môžu trpieť alifatickým uhľovodíkom, pričom spaľovanie je najdôležitejšie zo všetkých, pretože nerozlišuje žiadnu zlúčeninu; Všetci budú horieť v prítomnosti kyslíka, ale nie každý pridá molekuly alebo sa rozdelí na malé molekuly.
Chlapci
Alifatické uhľovodíky skupiny nekonečné zlúčeniny, ktoré sú zase klasifikované špecifickejšie, čo naznačuje stupeň ich nenasýtenia, ako aj typ štruktúry, ktorú majú.
Podľa toho, ako sú nenasýtení, máme alkány (nasýtené), alkénov a alkíny (nenasýtené).
Alkány sa vyznačujú jednoduchými odkazmi na C-C, zatiaľ čo v alkénoch a alkine pozorujeme odkazy C = C a C≡C, respektíve. Veľmi všeobecným spôsobom, ako si ich vizualizovať, je myslieť na uhlíkové kostry alkánov ako kľukatých a zložených reťazcov, ktoré sú „štvorcové“ pre alkény a „priame čiary“ pre alkíny.
Dôvodom je, že dvojité a trojité väzby majú v rotáciách energiu a stetenické obmedzenie, „tvrdenie“ ich štruktúr.
Alkitos a alkíny môžu byť rozvetvené, cyklické alebo polycyklické. Z tohto dôvodu sa cykloalcanos, cykloalquenos, cykloalkíny a zlúčeniny, ako je demalín (štruktúra bicyklov), Adamantano (podobne ako baseballová čiapka), heptalén, gonano, sa okrem iného považujú za alifatické uhľovodíky.
Z alkénov vznikajú iné typy uhľovodíkov, ako sú ciele (s dvoma dvojitými väzbami), poliené (s mnohými dvojitými alternatívnymi väzbami) a terpény (zlúčeniny odvodené od izoprénu, diénu).
Žiadosti
Použitie pre tieto uhľovodíky sa môžu opäť líšiť v závislosti od toho, ktorý z nich sa uvažuje. Avšak v úsekoch vlastností a reakcií sa objasnilo, že všetky spaľovanie nielen uvoľňuje molekuly plynu, ale aj svetlo a teplo. Sú to teda energetické nádrže, ktoré sú užitočné na to, aby slúžili ako palivá alebo zdroje tepla.
Preto sa používajú ako súčasť zloženia benzínu, pre zemný plyn, v zapaľovačoch Bunsen a vo všeobecnosti, aby boli schopní vzniknúť ohňom.
Môže vám slúžiť: oktetové pravidloJedným z najpozoruhodnejších príkladov je acetylén, HC≡CH, ktorého spaľovanie umožňuje excitovať kovové ióny vzorky v atómovej absorpčnej spektrometrii vykonanej pri analytických testoch. Podobne je možné výsledný oheň použiť na zvary.
Kvapalné alifatické uhľovodíky, ako napríklad paraffiniky, sa často používajú ako rozpúšťadlá extrakcie tukov. Okrem toho sa jeho pôsobenie rozpúšťadla môže použiť na odstránenie škvŕn, smaltov, obrazov alebo jednoducho na prípravu roztokov špecifickej organickej zlúčeniny.
Najväčšia molekulárna hmotnosť, už viskózna alebo pevná, je určená na vypracovanie živicových, polymérov alebo liekov.
Pokiaľ ide o termín „alifatický“, zvyčajne sa používa na označenie týchto regiónov v makromolekule, ktorá nemá aromaticitu. Napríklad asfaltény sú opísané povrchne ako aromatické jadro s alifatickými reťazcami.
Príklady
Spočiatku sa hovorilo, že metán je najjednoduchší alifatický uhľovodíky. Nasledujú propány, Cho3Chvály2Chvály3, Butano, ch3Chvály2Chvály2Chvály3, Pentano, ch3Chvály2Chvály2Chvály2Chvály3, oktán, nonano, dekan atď., ktorý má stále dlhšie alkány.
To isté platí pre etylén, cho2= CH2, Propeno, ch3Chrk2, Buteno, ch3Chvály2Chrk3, A pre zvyšok alkinov. Ak existujú dve dvojité putá, sú oley a ak sú viac ako dve, Polienas. Podobne môžu byť v tom istom kostre dvojité a trojité odkazy, čo zvyšuje štrukturálnu zložitosť.
Medzi cykloalcanos môžeme spomenúť cyklopropán, cyklobután, cyklopentano, cyklohexan, cykloheptano, cyklooktán, ako aj cyklohexen a cyklohexín. Zo všetkých týchto uhľovodíkov sa získajú rozvetvené deriváty, čím sa ďalej vynásobia dostupné príklady (napríklad 1,4-dimetylciclonohexano).
Z najreprezentatívnejších terpénov máme limonén, mentol, pinén, vitamín A, eskualaneno atď. Polyetylén je nasýtený polymér s jednotkami -ch2-Chvály2-, Je to tiež príklad týchto uhľovodíkov. Ďalšie príklady už boli uvedené v predchádzajúcich oddieloch.
Odkazy
- Morrison, r. Tón. a Boyd, R, N. (1987). Organická chémia. 5. vydanie. Redakčný Addison-Wesley Inter-American.
- Carey F. (2008). Organická chémia. (Šieste vydanie). MC Graw Hill.
- Graham Solomons t.W., Craig B. Fryhle. (2011). Organická chémia. Amín. (10. vydanie.). Wiley Plus.
- HelMestine, Anne Marie, PH.D. (22. augusta 2019). Definícia alifatických uhľovodíkov. Zotavené z: Thoughtco.com
- Wikipedia. (2019). Alifatická zlúčenina. Zdroj: In.Wikipedia.orgán
- Chémia librettexts. (20. augusta 2019). Alifatické uhľovodíky. Získané z: Chem.Librettexts.orgán
- Elizabeth Wyman. (2019). Alifatické uhľovodíky: Definícia a vlastnosti. Štúdium. Získané z: štúdie.com

