História Helio, vlastnosti, štruktúra, riziká, použitie

- 2485
- 781
- Blažej Hrmo
On hélium Je to chemický prvok, ktorého symbol je. Toto je prvý šľachtický plyn v periodickej tabuľke a zvyčajne sa nachádza na konci toho istého. Za normálnych podmienok je to inertný plyn, pretože žiadna z mála zlúčenín nie je stabilná; Veľmi rýchlo sa rozširuje a je látkou s najmenším bodom varu zo všetkých.
Na populárnej úrovni je to dobre známy plyn, pretože v nespočetných udalostiach alebo detských večierkoch je bežné. Čo sa však skutočne a navždy stratí v rohoch slnečnej sústavy a ďalej, sú to atómy hélia, ktoré sa uvoľňujú po rozložení zemegule.
 Balóny nafúknuté héliom, najbližšie, čo môže byť tohto prvku v každodenných situáciách. Zdroj: Pixabay.
Balóny nafúknuté héliom, najbližšie, čo môže byť tohto prvku v každodenných situáciách. Zdroj: Pixabay. V skutočnosti existujú tí, ktorí az veľkého dôvodu veria, že héliové balóny predstavujú nevhodnú prax pre tento plyn. Našťastie má dôležitejšie a zaujímavé použitie vďaka svojim fyzikálnym a chemickým vlastnostiam, ktoré ho oddeľujú od iných chemických prvkov.
Napríklad tekuté hélium je také chladné, že môže zmraziť čokoľvek, ako zliatinu kovu, čo z neho robí materiál supravodiča. Je to tiež tekutina, ktorá prejavuje superfluiditu, ktorá je schopná vyliezť na steny sklenenej nádoby.
Volá sa to, že bol prvýkrát identifikovaný na slnku a nie na zemi. Je to druhý najhojnejší prvok v celom vesmíre a hoci jeho koncentrácia je smiešna v zemskej kôre, dá sa získať z rezerv zemného plynu a rádioaktívnych minerálov uránu a tória.
Tu hélium demonštruje ďalšiu zvedavú skutočnosť: je to plyn, ktorý oplýva oveľa viac v podložisku ako v atmosfére, kde nakoniec unikne zo Zeme a jej gravitačného poľa.
[TOC]
História
Hélium nebolo objavené na Zemi, ale na slnku. V skutočnosti jeho meno pochádza z gréckeho slova „helios“, čo znamená slnko. Existencia samotného prvku kontrastovala s periodickou tabuľkou Dmitri Mendeléyev, pretože neexistovalo miesto pre nový plyn; To znamená, dovtedy nebolo o šľachetných plynoch absolútne nič.
Názov „Helio“, napísaný ako „hélium“ v angličtine, sa skončil príponou -ium, ktorá sa na ňu označuje ako kov; Presne preto, že existencia iného plynu, okrem kyslíka, vodíka, fluóru, chlóru a dusíka, nebolo možné pripustiť.
Tento názov bol určený anglickým astronómom Normanom Lockyerom, ktorý študoval z Anglicka, čo pozoroval francúzska astronóm.
Do tej doby to bola žltá spektrálna čiara neznámeho prvku. Lockyer povedal, že to bolo kvôli prítomnosti nového chemického prvku, ktorý sa nachádza na slnku.
V roku 1895, takmer o dvadsať rokov neskôr, škótsky chemik Sir William Ramsay uznal rovnaké spektrum zo zostávajúceho plynu pri štúdiu rádioaktívneho minerálu: Cleveíta. Preto tu bol aj Helio.
Fyzikálne a chemické vlastnosti
Vzhľad
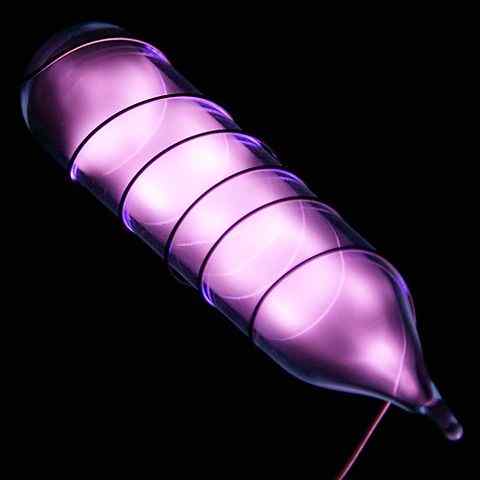 Ampulka so vzorkou hélia svietiaca po elektrickom šoku. Zdroj: Hi-RES Obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]
Ampulka so vzorkou hélia svietiaca po elektrickom šoku. Zdroj: Hi-RES Obrázky chemických prvkov [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)] Hélium je bezfarebný plyn bez zápachu, ktorý nemá chuť a je tiež inertný. Keď sa však aplikuje elektrický šok a v závislosti od rozdielu napätia, začne svietiť ako šedovko-morálna hmla (horný obrázok), potom svietiť oranžovou žiarením. Preto sú héliové svetlá oranžové.
Atómové číslo (z)
2
Molárna hmota
4,002 g/mol
Bod topenia
-272.2 ° C
Bod varu
-268,92 ° C
Hustota
-0,1786 g/l, za normálnych podmienok, to znamená v plynnej fáze.
-0,145 g/ml, v bode topenia, tekuté hélium.
-0,125 g/ml, práve keď sa hélium začne variť.
-0,187 g/ml, pri 0 K a 25 atm, to znamená tuhé hélium na špecifické podmienky tlaku a teploty.
Trojitý bod
2 177 K a 5 043 kPa (0,04935 ATM)
Kritický bod
5,1953 K a 0,22746 MPa (2 2448 ATM)
Fúzne teplo
0,0138 kJ/mol
Odparovanie
0,0829 kJ/mol
Kapacita moláru
20,78 J/(mol · k)
Tlak vodnej pary
0,9869 atm pri 4,21 K. Táto hodnota slúži na to, aby poskytla predstavu o tom, ako flotila.
Ionizačné energie
-Prvé: 2372,3 kJ/mol (on+ plyn)
-Po druhé: 5250,5 kJ/mol (on2+ plyn)
Ionizačné energie pre hélium sú obzvlášť vysoké, pretože atóm plynu musí stratiť elektrón, ktorý má silné účinné jadrové zaťaženie. Dá sa tiež pochopiť, či sa zvažuje malá veľkosť atómu a ako sú „blízke“ dva elektróny vzhľadom na jadro (s ich dvoma protónmi a dvoma neutrónmi).
Rozpustnosť
Vo vode sa 0,97 ml rozpustí na 100 ml vody pri 0 ° C, čo znamená, že je málo rozpustný.
Môže vám slúžiť: oxalát amónnehoReaktivita
Hélium je druhým najmenej reaktívnym chemickým prvkom v prírode. V normálnych podmienkach je úspešný potvrdiť, že ide o inertný plyn; Nikdy (pre to, čo sa zdá), sa nedá manipulovať so zlúčeninou hélia v miestnosti alebo laboratóriu bez toho, aby na ňu pôsobili obrovské tlaky; Alebo možno, dramaticky vysoké alebo nízke teploty.
Príklad, ktorý vidíme v zlúčenine NA2On, ktorý je stabilný iba pod tlakom 300 GPa, sa reprodukuje v bunke s diamantovým junque.
Zatiaľ čo chemické väzby v NA2Mať „cudzincov“ za to, že ich elektróny sú dobre umiestnené v kryštáloch, nie sú ani zďaleka jednoduché interakcie van der stien, a preto sa nepotýka iba z atómov hélia zachytených molekulárnymi agregátmi. Tam je dilema, medzi ktorými sú héliové zlúčeniny skutočné a ktoré nie.
Napríklad molekuly dusíka na vysoké tlaky môžu uväzniť atóm hélia, aby spôsobil určitý druh rastu2)jedenásť.
Tiež existujú endo -subvertujúce komplexy fullerénových katiónov, C60+n a c70+n, u ktorých dutiny môžu umiestniť atómy hélia; a molekulárny katión heh+ (HE-H+), nájdené vo veľmi vzdialených hmlovinách.
Oxidačné číslo
Kto sa zo zvedavosti pokúša vypočítať oxidačné číslo pre hélium v ktorejkoľvek z jeho zlúčenín zistí, že sa to rovná 0. V NA2Napríklad by sa dalo predpokladať, že jeho vzorec zodpovedá hypotetickým iónom2+On2-; Ale také by bolo predpokladať, že má čistý iónový charakter, keď v skutočnosti jeho väzby nie sú ani zďaleka.
Okrem toho hélium nevyhráva elektróny, pretože ich nemôže ubytovať v orbitálnej, nedostupnej energii; A ani nie je možné, že ich stratíte, kvôli zníženej veľkosti jeho atómu a veľkému účinnému jadrovému zaťaženiu jeho jadra. Preto sa hélium vždy podieľa (teoreticky) ako atóm0 Vo svojich odvodených zlúčeninách.
Elektronická štruktúra a konfigurácia
Hélium, rovnako ako všetky plyny pozorované v makroescale, zaberá objem kontajnerov, ktoré ich ukladajú, a tak má neurčitú cestu. Keď však teplota zostupuje a začne ochladiť pod -269 ° C, plyn kondenzuje v bezfarebnej kvapaline; Hélium I, prvá z dvoch kvapalných fáz pre tento prvok.
Dôvod, prečo hélium kondenzuje pri takej nízkej teplote, je spôsobený niekoľkými disperznými silami, ktoré udržujú ich atómy pohromade; Čokoľvek sa fáza uvažuje. To možno vysvetliť z jeho elektronickej konfigurácie:
1s2
V ktorom dva elektróny zaberajú atómový orbitál 1S. Atóm hélia sa dá vizualizovať ako takmer dokonalá guľa, ktorej homogénny elektronický perifér nie je príliš náchylný na polarizáciu účinným jadrovým zaťažením týchto dvoch protónov v jadre.
Spontánne a indukované dipólové momenty sú teda neobvyklé a veľmi slabé; Teplota sa musí priblížiť k absolútnej nule, aby sa atómy priblížili dostatočnej pomalosti a aby ich disperzné sily definovali kvapalinu; Alebo ešte lepšie, héliové sklo.
Diméry
V plynnej fáze priestor, ktorý oddeľuje atómy, má taký, že sa dá predpokladať, že jeden z ostatných je vždy oddelený. Natoľko, že v pľuzgieri, s malým objemom, hélium vyzerá bezfarebne, až kým nie je vystavené elektrickému šoku, ktorý ionizuje jeho atómy v šedej a malej jasnej hmle.
Avšak v kvapalnej fáze majú atómy, a to aj pri slabých interakciách, už nemôžu „ignorovať“ po dlhšiu dobu. Teraz im disperzná sila umožňuje2. Preto si môžete myslieť na hélium I ako na obrovské zhluky2 v rovnováhe s atómami fázy pary.
Preto je hélium I tak ťažké odlíšiť od jeho výparov. Ak sa táto tekutina rozliate mimo hermetického nádoby, uniká ako belavý svetlica.
Helio II
Keď teplota klesne ešte viac, dotkne sa 2 178 K (-270 972 ° C), dochádza k fázovému prechodu: hélium I sa transformuje na hélium II II II.
Od tohto bodu sa fascinujúca tekutina hélia stáva zbytočnou alebo kvantovou tekutinou; to znamená, že jeho makroskopické vlastnosti sa prejavujú ako diméry2 Boli to individuálne atómy (a možno sú). Chýba mu úplná viskozita, pretože neexistuje žiadny povrch, ktorý by mohol zastaviť atóm počas jeho posuvného alebo „lezenia“.
Preto môže Helio II vstať cez steny skleneného nádoby prekonať gravitáciu; Bez ohľadu na to, aké vysoké sú, pokiaľ povrch zostáva pri rovnakej teplote, a preto netušia.
Môže vám slúžiť: kyselina hypofyzárna (H3PO2): Vlastnosti, použitie a činidláZ tohto dôvodu sa tekutý hélium nedá skladovať v sklenených nádobách, pretože uniklo pred najmenšou trhlinou alebo medzerou; Veľmi podobné tomu, ako by sa to stalo s plynom. Namiesto toho sa nehrdzavejúca oceľ používa na navrhovanie týchto nádob (tanky Dewars).
Kryštály
Aj keď teplota zostúpila do 0 K (absolútna nula), disperzná sila medzi atómami by som nebol dostatočne silný na to, aby som ich objednal v kryštalickej štruktúre. Aby sa upevnil, tlak sa musí zvýšiť na približne 25 atm; A potom sa objavia kompaktné šesťuholníkové kryštály (HCP).
Geofyzikálne štúdie ukazujú, že táto štruktúra HCP zostáva zďaleka nezmenená, že sa zvyšuje tlak (až do poradia Pascal Giga, GPA). V jej diagrame tlakovej teploty je však úzka oblasť, kde tieto kryštály HCP trpia prechodom na kubickú fázu zameranú na telo (BCC).
Kde je to a získajte
Kozmos a skaly
 Hélium predstavuje druhý najhojnejší prvok vesmíru a 24% jeho hmoty. Zdroj: pxhere.
Hélium predstavuje druhý najhojnejší prvok vesmíru a 24% jeho hmoty. Zdroj: pxhere. Hélium je druhým najhojnejším prvkom v celom vesmíre, ktorý prekonal iba vodík. Hviezdy neustále produkujú nesmierne množstvo atómov hélia zlúčením dvoch vodíkových jadier počas procesu nukleosyntézy.
Podobne aj akýkoľvek rádioaktívny proces, ktorý vyžaruje a častice a je zdrojom výroby atómov hélia, ak interagujú s elektrónmi životného prostredia; Napríklad s telesami skalného tela v nádržiach rádioaktívnych minerálov uránu a tória. Tieto dva prvky trpia rádioaktívnym rozkladom, počnúc uránom:
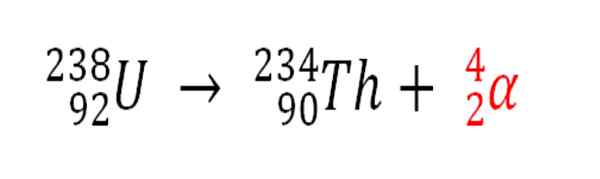 Rádioaktívny rozklad v uráne pri tvorbe častíc Alfas, ktoré sa následne transformujú na atóm hélia v podzemných depozitoch. Zdroj: Gabriel Bolívar.
Rádioaktívny rozklad v uráne pri tvorbe častíc Alfas, ktoré sa následne transformujú na atóm hélia v podzemných depozitoch. Zdroj: Gabriel Bolívar. Preto v horninách, kde sú tieto rádioaktívne minerály koncentrované, sa zachytia atómy hélia, ktoré sa uvoľnia, keď sa strávia v kyslom médiu.
Medzi niektoré z týchto minerálov patrí Cleveíta, Carnotita a uraninit, všetky zložené z oxidov uránu (UO2 alebo u3Ani8) a nečistoty tória, ťažkých kovov a vzácnych zemín. Hélium, zavlažované podzemnými kanálmi, sa môže skončiť hromadením v nádržiach zemného plynu, minerálnych prameňoch alebo v meteorických žehličkách.
Odhaduje sa, že hmotnosť hélia, ktorá sa rovná 3 000 ton, sa vyrába ročne, z rádioaktívneho rozkladu uránu a tória.
Vzduch a moria
Hélium nie je príliš rozpustné vo vode, takže skôr ako neskôr skončí stúpajúcim z hĺbky (kde sa nachádza jeho pôvod), aby prekročil vrstvy atmosféry a nakoniec dosiahol sideálny priestor. Jeho atómy sú také malé a ľahké, že gravitačné pole Zeme ich nemôže udržať v atmosfére.
Z dôvodu vyššie uvedeného je koncentrácia hélia vo vzduchu (5,2 ppm) aj v moriach (4 ppt) veľmi nízka.
Ak by ste chceli extrahovať z niektorého z týchto dvoch médií, „najlepšou“ možnosťou by bol vzduch, ktorý by ho najprv musel predložiť na skvapalnenie, aby kondenzoval všetky jeho komponenty, zatiaľ čo hélium zostáva v plynnom stave.
Nie je však praktické získať hélium zo vzduchu, ale z hornín obohatených rádioaktívnymi minerálmi; Alebo ešte lepšie, rezervy zemného plynu, kde hélium môže predstavovať až 7% z celkovej hmoty.
Skvapanie a destilácia zemného plynu
Namiesto podrobenia vzduchu je to jednoduchšie a výnosnejšie. Surovinkou materiálmi je par excellencia (komerčná) na získanie hélia je zemný plyn, ktorý je možné podrobiť aj frakčnej destilácii.
Konečný produkt destilácie sa dokončí čistenie aktívnym uhlím, ktorý prechádza héliom s veľkou čistotou. A nakoniec, hélium sa oddeľuje od neónu cez kryogénny proces, kde sa používa kvapalný hélium.
Izotopy
Hélium je prezentované prevažne ako izotop 4On, ktorého nahé jadro je slávna častica α. Tento atóm 4Mám dva neutróny a dva protóny. V menšej hojnosti je izotop 3On, ktorý má iba jeden neutrón. Prvý je ťažší (má väčšiu atómovú hmotu) ako druhá.
Teda pár izotopov 3On a on a 4Majú sú tie, ktoré definujú mezútené vlastnosti a čo chápeme héliu ako chemickému prvku. Od 3Je ľahší, predpokladá sa, že ich atómy majú viac kinetickej energie, a preto potrebujú ešte nižšiu teplotu na súdržnosť v zbytočnom.
On 3Uvažoval som o veľmi zriedkavých druhoch tu na Zemi; Avšak v lunárnych pôdach je hojnejší (približne 2000 krát). Preto bol Mesiac vystavený projektom a príbehom ako možný zdroj 3On, ktorý by sa mohol použiť ako jadrové palivo pre kozmickú loď budúcnosti.
Môže vám slúžiť: čisté látkyOkrem iných je možné spomenúť izotopy hélia, s príslušnými časmi polovice života: 5On (tón1/2= 7,6,10-22 s), 6On (tón1/2= 0,8 s) a 8On (tón1/2= 0,119 s).
Riziká
Hélium je inertný plyn, a preto sa nezúčastňuje žiadnej z reakcií, ktoré sa vyskytujú v našich telách.
Jeho atómy prakticky vstupujú a vydychujú sa bez ich interakcií s biomolekúlmi, ktoré majú následný účinok; s výnimkou zvuku emitovaného z hlasivkových káblov, ktoré sa stávajú akútnymi a majú viac frekvencie.
Ľudia, ktorí vdychujú Helio z balóna (s mierou), hovoria akútnym hlasom podobným hlasu veveričky (alebo kačice).
Problém spočíva v tom, že ak uvedená osoba vdýchne nevhodné množstvo hélia, riziko dusenia, pretože ich atómy sa presúvajú do molekúl kyslíka; A preto nebude schopný dýchať, kým všetko, čo hélium vydychuje, čo v dôsledku jeho tlaku môže roztrhnúť pľúcne tkanivo alebo spôsobiť barotraumy.
Prípady ľudí, ktorí zomreli na vdych Helio, boli hlásené kvôli novo vysvetleným.
Na druhej strane, hoci to nepredstavuje riziko požiaru vzhľadom na jeho nedostatok reaktivity voči kyslíku (alebo inej látke), ak je uložená pod vysokými tlakmi a únikom, jeho únik môže byť fyzicky nebezpečný.
Žiadosti
Fyzikálne a chemické vlastnosti spoločnosti Helio z neho nielen robia špeciálny plyn, ale aj veľmi užitočnú látku pre aplikácie, ktoré si zaslúžia teploty v extrémne nízkom. V tejto časti sa riešia niektoré z týchto aplikácií alebo použitia.
Systémy tlaku a čistenia
V niektorých systémoch je potrebné zvýšiť tlak (tlakom), a preto sa musí vstrekovať alebo napájať, ktoré neinteraguje so žiadnym z jeho komponentov; Napríklad s činidlami alebo povrchmi citlivými na nežiaduce reakcie.
Troj sa teda môže zvýšiť objemami hélia, ktorých chemická zotrvačnosť je na tento účel ideálna. Inertná atmosféra, ktorá uľahčuje, presahuje v niektorých prípadoch dusíka.
Pre spätný proces, to znamená, vyčistenie, hélium sa používa aj kvôli jeho schopnosti ťahať všetky kyslíky, vodné pary alebo akýkoľvek iný plyn, ktorého prítomnosť si želá odstrániť. Týmto spôsobom sa tlak systému zníži po vyprázdnení hélia.
Detekcia úniku
Hélium sa môže filtrovať cez najmenšiu trhlinu, takže slúži aj na detekciu únikov v potrubiach, vysokohorských nádobách alebo kryogénnych nádržach.
Niekedy je možné detekciu vykonávať vizuálne alebo dotykom; Väčšinou však detektor „hodí“ signál, kde a koľko hélium uniká systému pri kontrole.
Pretiahnuť plyn
Atómy hélia, ako je uvedené pre očistné systémy, ho môžu ťahať, v závislosti od vášho tlaku, ťažšie molekuly. Napríklad tento princíp sa používa denne v analýze plynovej chromatografie, pretože môže pretiahnuť vzorku atomizovanú pozdĺž stĺpca, kde interaguje so stacionárnou fázou.
Balóny a vzducholode
 Hélium sa používa na nafúknutie vzducholodí a je oveľa bezpečnejšie ako vodík, pretože nie je horľavým plynom. Zdroj: Pixabay.
Hélium sa používa na nafúknutie vzducholodí a je oveľa bezpečnejšie ako vodík, pretože nie je horľavým plynom. Zdroj: Pixabay. Vďaka svojej nízkej hustote v porovnaní so vzduchom a opäť na jeho nedostatok reaktivity s kyslíkom sa používa na nafúknutie balónov na detských stranách (zmiešané s kyslíkom, takže nikto nie je udusený na dýchanie) a vzducholodí (vynikajúci obraz) , bez toho, aby bol schopný reprezentovať riziko požiaru.
Ponoriť sa
 Hélium je jednou z hlavných zložiek kyslíkových nádrží, s ktorými potápači dýchajú. Zdroj: pxhere.
Hélium je jednou z hlavných zložiek kyslíkových nádrží, s ktorými potápači dýchajú. Zdroj: pxhere. Keď potápači zostúpia do väčších hĺbok, je pre nich ťažké dýchať v dôsledku veľkého tlaku vyvíjaného vodou. Preto sa Helio pridáva do svojich kyslíkových nádrží, aby sa znížila hustota plynu, ktorú potápači dýchajú a vydýchajú, a preto sa dá vydýchnuť s menšou prácou.
Oblúkové zváranie
V procese zvárania elektrický oblúk prináša dostatok tepla tak, aby boli tieto dva kovy spojené. Ak sa vykonáva v atmosfére hélia, žiarivý kov nebude reagovať s kyslíkom vzduchu, aby sa stal jeho príslušným oxidom; Preto hélium to bráni tomu, aby sa to stalo.
Supravodič
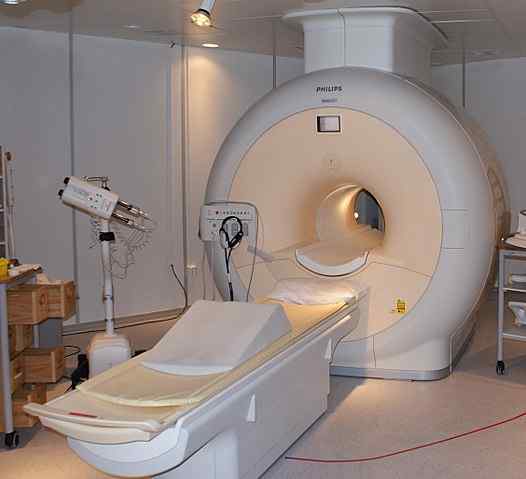 Kvapalný hélium sa používa na chladenie magnetov použitých v skeneroch zobrazovania jadrovej magnetickej rezonancie. Zdroj: Jan Ainali [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)]
Kvapalný hélium sa používa na chladenie magnetov použitých v skeneroch zobrazovania jadrovej magnetickej rezonancie. Zdroj: Jan Ainali [CC po 3.0 (https: // creativeCommons.Org/licencie/o/3.0)] Tekuté hélium je také chladné, že môže zmraziť kovy, aby ich transformoval na supravodiče. Vďaka tejto.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Andy Estance. (17. apríla 2019). Hydridový ión hélia sa zistil prvýkrát vo vesmíre: Dôkazy nájdené pre nepolapiteľnú chémiu z prvej minúty vesmíru. Získané z: Chemistryworld.com
- Peter Wothers. (19. augusta 2009). Hélium. Chémia vo svojom prvku. Získané z: Chemistryworld.com
- Wikipedia. (2019). Hélium. Zdroj: In.Wikipedia.orgán
- Mao, h. Klimatizovať., Wu a., Jefcoat, a. P., Hemley, r. J., Bell, P. M., & Bassett, W. Do. (1988). Kryštalická štruktúra a hustota hélia do 232 kbar. Zdroj: články.Adsabs.Harvard.Edu
- Národné centrum pre biotechnologické informácie. (2019). Hélium. Databáza pubchem. CID = 23987. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Mary-Ann Muffoletto. (6. februára 2017). Hore, hore a preč: chemici hovoria „áno,“ hélium môže tvoriť zlúčeniny. Štátna univerzita v Utahu. Získané z: Phys.orgán
- Steve Gagnon. (s.F.). Izotopy prvku hélium. Laboratórium Jefferson. Zotavené z: vzdelávania.JLab.orgán
- Adameg, Inc. (2019). Hélium. Získané z: ChemistryExplaed.com

