Halogény
- 3050
- 151
- MUDr. Miloslav Habšuda
 Prvky sú 5: fluorid, chlór, bróm, jód a preformulovanie
Prvky sú 5: fluorid, chlór, bróm, jód a preformulovanie Čo sú halogény?
Ten halogény Sú to nemetalické prvky, ktoré patria do skupiny VIIA alebo 17 periodickej tabuľky. Majú vysokú elektronickú elektronegativitu a afinity, ktoré majú výrazný vplyv na iónový charakter ich väzieb s kovmi. Slovo „halogenos“ je gréckeho pôvodu a znamená „soli solí“.
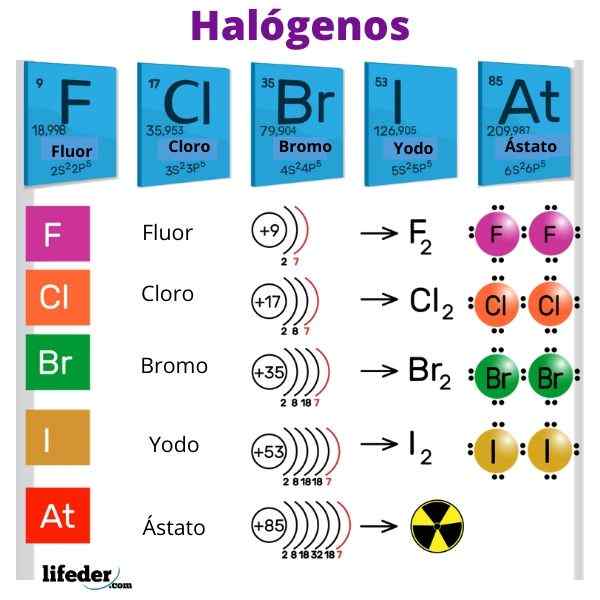
Halogény sú fluorid (F), chlór (CL), bróm (BR), jód (I) a rádioaktívny a efemérny prvok Ástato (AT). Sú tak reaktívni, že reagujú medzi sebou, aby vytvorili diatomické molekuly: f2, Cl2, Br2, Jo2 a pri2.
Tieto molekuly sa vyznačujú podobnými štrukturálnymi vlastnosťami (lineárne molekuly), hoci s rôznymi fyzikálnymi stavmi.
Aký je vzhľad halogénov?
Na spodnom obrázku sú zobrazené tri halogény. Zľava doprava: chlór, bróm a jód. Fluór ani janteate sa nemôžu skladovať v sklenených nádobách, pretože títo nezdržiavajú ich korozivitu. Všimnite si, ako sa organoleptické vlastnosti halogénov menia, keď sa ich skupina zostúpi na jódový prvok.
 Vzhľad halogénov. Zdroj: Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], cez Wikimedia Commons
Vzhľad halogénov. Zdroj: Zdroj: W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], cez Wikimedia Commons Fluór je plyn žltkastných tónov; Aj chlór, ale žlto-zelený; Bromo je tmavo červenkastá tekutina; Jód, čierna pevná látka s fialovými visos; A astat, tmavá a svetlá kovová pevná látka.
Halogény sú schopné reagovať takmer so všetkými prvkami periodickej tabuľky, a to aj s niektorými ušľachtilými plynmi (napríklad Xenon a Kripton). Keď tak urobia, môžu oxidovať atómy do svojich najpozitívnejších oxidačných stavov, čím sa stanú silnými oxidačnými činidlami.
Podobne dávajú molekulám špecifické vlastnosti, keď sú niektoré z ich atómov prepojené alebo nahradené. Tieto typy zlúčenín sa nazývajú haluros. Haluros v skutočnosti predstavuje hlavný prírodný zdroj halogénov a mnohé z nich sú rozpustené v mori alebo sú súčasťou minerálu; To je prípad fluoritu (CAF2).
Halogény aj haluros majú širokú škálu použití, od priemyselných alebo technologických, aby jednoducho zvýraznili chuť určitých potravín, ako to robí sodná soľ (chlorid sodný) (chlorid sodný) (chlorid sodný).
Fyzikálne a chemické vlastnosti halogénov
Atómové hmotnosti
Fluorid (F) 18,99 g/mol; Chlór (CL) 35,45 g/mol; Bromo (BR) 79,90 g/mol; Jód (i) 126,9 g/mol a astato (AT) 210 g/mol.
Fyzický stav
F plyn; Plynný cl; Tekutina; Som pevná a pevná.
Farba
F, bledo žltý grind; CL, svetlo zelená; Br, červeno-hnedá; Ja, fialová a at, kovová čierna * * (predpokladá sa)
Fúzne body
F -219,6 ° C; CL -101,5 ° C; BR -7,3 ° C; I 113,7 ° C a pri 302 ° C.
Body varu
F -118,12 ° C; Cl -34,04 ° C; BR 58,8 ° C; I 184,3 ° C a ?Pri 337 ° C.
Hustota pri 25 ° C
F- 0,0017 g/cm3; CL-0,0032 g/cm3; BR-3 102 g/cm3; I- 4,93 g/cm3 a pri 6.2-6,5 g/cm3
Rozpustnosť
CL-0,091 mmol/cm3; BR-0,21 mmol/cm3 a I- 0,0013 mmol/cm3.
Ionizačná energia
F- 1.681 kJ/mol; Cl- 1.251 kJ/mol; BR-1,140 kJ/mol; I- 1,008 kJ/mol a pri 890 kJ/mol.
Elektronegativita
F- 4,0; CL- 3,0; 2,8; I- 2,5 a na 2,2.
Halogény majú vo svojej valenčnej vrstve 7 elektrónov, a preto ich veľká avidita vyhrať elektrón. Halogény majú tiež vysokú elektronegativitu v dôsledku svojich malých atómových rádií a veľkej príťažlivosti, ktorú jadro na elektronoch Valencie uplatňuje.
Môže vám slúžiť: zákon o hromadnej akciiReaktivita
Halogény sú vysoko reaktívne, čo by potom vysvetlilo ich toxicitu. Okrem toho sú oxidačnými činidlami.
Klesajúce poradie reaktivity je: f> cl> b> i> at.
V prírode
Kvôli svojej veľkej reaktivite nie sú atómy halogénu voľné, ale tvoria agregáty alebo ako diatomické molekuly spojené kovalentnými väzbami.
Molekulárne štruktúry
Halogény neexistujú v prírode ako elementárne atómy, ale ako diatomické molekuly. Všetci však majú spoločnú lineárnu molekulárnu štruktúru a jediný rozdiel spočíva v dĺžke ich väzieb a ich intermolekulárnych interakcií.
Lineárne molekuly x-x (x2) Sa vyznačujú tým, že sú nestabilné, pretože oba atómy k nim silne priťahujú dvojicu elektrónov. Pretože? Pretože jeho externé elektróny zažívajú veľmi vysoko efektívne jadrové zaťaženie, ZEF. Hlavný ZEF, menej bude vzdialenosť odkazu X-X.
Keď skupina zostupuje, ZEF sa stáva slabšou a stabilita týchto molekúl sa zvyšuje. Preto klesá poradie reaktivity: f2> Cl2> Br2> I2. Je však nezmyselné porovnávať ostat s fluórom, pretože nie je známy izotop.
Intermolekulárne interakcie
Na druhej strane, jeho molekulámi chýba dipólový moment, ktorý je apolar. Táto skutočnosť je zodpovedná za jej slabé intermolekulárne interakcie, ktorých jedinou latentnou silou je disperzia alebo Londýn, čo je úmerné atómovej hmotnosti a molekulárnej oblasti.
Týmto spôsobom malá molekula f2 nemá dostatok hmotnosti alebo elektrónov na vytvorenie tuhej látky. Na rozdiel od i2, Molekula jódu, ktorá je napriek tomu naďalej pevná, ktorá vydáva fialové výpary.
Bromo predstavuje medziprodukt medzi oboma koncami: BR molekuly2 Dostatočne interagujú, aby sa objavili v kvapalnom stave.
Opätovné preformáty, pravdepodobne kvôli jeho rastúcemu kovovému charakteru, sa nepredstavuje ako2 ale ako atómy até, ktoré tvoria kovové spojenia.
Pokiaľ ide o jeho farby (žlto-žltý zelenkavo-červený-Mudad-Negro), najvhodnejšie vysvetlenie je založené na molekulárnej orbitálnej teórii (Tom). Energetická vzdialenosť medzi posledným plným molekulárnym orbitálom a ďalšou väčšou energiou (Antienlace) je prekročená absorpciou fotónu so stále väčšími a väčšími vlnovými dĺžkami.
Haluróz
Halogény reagujú na tvorbu haluros, či už anorganické alebo organické. Najznámejšie sú halogenidy vodíka: fluorid vodíka (HF), chlorid vodíka (HCL), vodíkový bromid (HBR) a jodid vodíka (HI).
Všetky z nich rozpustené vo vode vytvárajú kyslé roztoky; tak kyslé, že HF môže degradovať akúkoľvek sklenenú nádobu. Okrem toho sa pre syntézu extrémne silných kyselín posudzujú východiskové materiály.
Existujú tiež tak -zavolané halogenidy kovov, ktoré majú chemické vzorce, ktoré závisia od kovovej valencie. Napríklad halogenidy alkalických kovov majú halogenidy MX a medzi nimi sú: NaCl, chlorid sodný; KBR, bromid draselný; CSF, fluorid cézia; a lii, lítiumjodid.
Alkalinoterrózne kovy, prechodné kovy alebo kovy bloku P, majú vzorec MXn, N je pozitívne zaťaženie kovom. Niektoré z nich sú teda: FECL3, Trichlorid železitý; Mgbr2, Bromid horčíka; ALF3, Hliník Trifluoruro; a cui2, Cupic jodid.
Môže vám slúžiť: síran draselný (K2SO4): Štruktúra, vlastnosti, použitie, syntézaHalogény však môžu tiež tvoriť väzby s atómami uhlíka; Preto môžu zasahovať do komplexného sveta organickej chémie a sveta biochémie. Tieto zlúčeniny sa nazývajú organické halogenidy a sú to všeobecne chemický vzorec, ktorý je x niektorý z halogénov.
Použitie/halogénové aplikácie
Chlór
V priemysle
-Bromo a chlór sa používajú v textilnom priemysle na bielenie a ošetrenie vlny, čím sa pri mokli vyhýbajú zmenšeniu.
-Používa sa ako dezinfekčný prostriedok ditritu a na čistenie pitnej vody a bazénov. Okrem toho sa zlúčeniny odvodené od chlóru používajú v práčovni a v papierovom priemysle.
-Nájdite použitie pri výrobe špeciálnych batérií a chlórovaných uhľovodíkov. Používa sa tiež pri spracovaní mäsa, zeleniny, rýb a ovocia. Chlór tiež funguje ako baktericídne činidlo.
-Používa sa na čistenie a prepustenie kože a bielidla celulózy. Predtým sa ako mixér a kondicionér múky používal trichlorid dusíka.
-Fosfén (COCL2) Sa používa v mnohých procesoch priemyselnej syntézy, ako aj pri výrobe vojenských plynov. Fosfán je veľmi toxický a je zodpovedný za početné úmrtia v prvej svetovej vojne, kde sa používal plyn.
-Tento plyn sa nachádza aj u insekticídov a fumigantov.
-NaCl je veľmi hojná soľ, ktorá sa používa na ochutenie potravín a pri ochrane dobytka a vtáčieho mäsa. Okrem toho sa používa v telesných rehydratačných tekutinách, ústne aj intravenózne.
V medicíne
-Halogénové atómy, ktoré sa viažu na lieky, ich robia viac lipofilnejší. To umožňuje liekom prechádzať ľahšie bunkové membrány, ktoré sa rozpúšťajú v lipidoch, ktoré ich tvoria.
-Chlór sa šíri vo vnútri neurónov centrálneho nervového systému prostredníctvom iónových kanálov spojených s neurotransmitermi GABA receptormi, čím sa vytvára sedačný účinok. Toto je mechanizmus pôsobenia niekoľkých anxiolytík.
-HCl je prítomný v žalúdku, kde zasahuje vytváranie redukčného prostredia, ktoré uprednostňuje spracovanie potravín. Okrem toho HCL aktivuje pepsín, enzým, ktorý začína hydrolýzu proteínov, štádium pred črevnou absorpciou proteínového materiálu.
Ďalší
-Kyselina chlorovodíková (HCL) sa používa pri čistení kúpeľní, vo výučbových a výskumných laboratóriách a v mnohých odvetviach.
-PVC (polyvinylchlorid) je vinylchloridový polymér, ktorý sa používa v odeve, podlahy pre podlahy, elektrické káble, flexibilné trubice, potrubia, nafukovacie štruktúry a strešné dlaždice. Chlór sa okrem toho používa ako sprostredkovateľ pri vypracovaní iných plastových materiálov.
-Chlór sa používa pri extrakcii brómu.
-Metylchlorid spĺňa anestetickú funkciu. Používa sa tiež na vypracovanie určitých silikónových polymérov a pri extrakcii tukov, olejov a živíc.
-Chloroform (CHCL3) je rozpúšťadlo používané v mnohých laboratóriách, najmä v organických a biochemických chemických laboratóriách, od výučby, po výskumných pracovníkov.
-A nakoniec, vzhľadom na chlór, trichlóretylén sa používa na odmasťovanie kovových častí.
Bróm
-Bromo sa používa v procese ťažby zlata a pri vŕtaní ropných a plynových vrtov. Používa sa ako retardér spaľovania v plastickom a plynárenskom priemysle. Bromo izoluje kyslíkový oheň, ktorý spôsobuje vypnutie.
Môže vám slúžiť: metabisulfit sodný (Na2S2O5): Štruktúra, vlastnosti, použitia, riziká-Je sprostredkovateľom pri výrobe hydraulických kvapalín, látok na chladivo a odvlhčovače a pripravený na formovanie vlasov. Bromid draselný sa používa pri výrobe tanierov a fotografických papierov.
-Bromid draselný sa používa aj ako antikonvulzívny, ale kvôli možnosti, že soľ môže spôsobiť neurologické dysfunkcie, sa jej použitie znížilo. Okrem toho je ďalším z jeho bežných použití ako tabletka pre tuhé vzorky infračervenej spektroskopie.
-Zlúčeniny Bromo sú prítomné v liekoch používaných pri liečbe pneumónie. Podobne sú zlúčeniny brómov začlenené do liekov používaných v testoch, ktoré sa vykonávajú pri liečbe Alzheimerovej choroby.
-Bromo sa používa na zníženie znečistenia ortuti v elektrických rastlinách, ktoré používajú uhlie ako palivo. Používa sa tiež v textilnom priemysle na vytváranie rôznych farbičiek farieb.
-Metylbrominát sa použil ako pesticíd na fumigáciu pôdy a domov, ale jeho škodlivý vplyv na ozón obmedzilo jeho použitie.
-Halogénové žiarovky sú žiarovky a súhrn malých množstiev brómu a jódu umožňuje zníženie veľkosti žiaroviek.
Jód
-Jód zasahuje do fungovania štítnej žľazy, regulačný hormón metabolizmu tela. Štítna žľaza tajomstvá hormónov T3 a T4, ktoré vyvíjajú svoju činnosť na svojich bielych orgánoch. Napríklad hormonálny účinok na srdcový sval spôsobuje zvýšenie krvného tlaku a srdcovej frekvencie.
-Podobne sa jód používa na identifikáciu prítomnosti škrobu. Silver Yoduro je činidlo používané pri odhalení fotografií.
Fluór
-Niektoré fluoridové zlúčeniny sa pridávajú do zubných pastov, aby sa zabránilo vzhľadu zubného kazu. Deriváty fluóru sú prítomné v niekoľkých anestetikách. Vo farmaceutickom priemysle začleňujú fluorid do liekov na štúdium možných zlepšení ich účinkov na telo.
-Kyselina fluórska sa používa na zaznamenávanie skla. Aj pri výrobe halónov (hasiace prístroje, ako napríklad Fry). Fluoridová zlúčenina sa používa pri elektrolýze hliníka na dosiahnutie jej čistenia.
-Povlaky antireflejantes obsahujú fluórovú zlúčeninu. Používa sa na výrobu plazmových obrazoviek, plochých obrazoviek a mikroelektromechanických systémov. Fluór je tiež prítomný v hline používanej v nejakej keramike.
Preformulovať
Predpokladá sa, že preformát by mohol prispieť k jódu v regulácii fungovania štítnej žľazy. Aj jeho rádioaktívny izotop (210At) sa používa v štúdiách rakoviny u myší.
Odkazy
- Encyklopédia zdravia a bezpečnosti v práci. Halogény a jeho zlúčeniny. [PDF]. Prevzaté z:
- zamestnanie.Škriatok.je
- Chémia librettexts. Skupina 17: Všeobecné vlastnosti halogénov. Prevzaté z: chem.Librettexts.orgán
- Wikipedia. (2018). Halogén. Prevzaté z: v.Wikipedia.orgán
- Jim Clark. (Máj 2015). Atómové a fyzikálne vlastnosti prvkov skupiny 7 (halogény). Zobraté z: Chemguide.co.Uk
- Whitten, K. W., Davis, R. A., Peck, m. L. A Stanley, G. G. Chemistry (2003), 8. vydanie. Učenie sa.
- Predmety. Halogény. Prevzaté z: prvky.orgán.je
- Hnedý, vavrín. (24. apríla 2017). Halogénové charakteristiky. Vedecký. Obnovené z: vedeckých.com

