Galvanoplastika

- 1574
- 242
- Tomáš Mydlo
Vysvetľujeme, čo galvanoplastika pozostáva z tiež nazývaného elektrodepozícia, aký je jej proces, praktické príklady a jej aplikácie.
 Galvanoplastika lyžice
Galvanoplastika lyžice Čo je galvanoplastika?
Galvanoplastika alebo elektronepozícia je elektrochemická technika, ktorá pozostáva, ako naznačuje jeho názov, pri ukladaní vrstiev kovov na prijímanie predmetov; To znamená, že ich zakryte z kovového krytu, ktorého hrúbka sa pohybuje medzi 5 až 20 μm.
Táto technika je tiež známa ako elektrochapado alebo elektrolytické planované, ako elektrolytické médium zložené z kovových iónov kovu, ktorý je potrebné uložiť, je nevyhnutné na jeho implementáciu. Preto, ak chceme medi (meď), budeme potrebovať medené rozpustné soli, ako je síran meďnatého, rozpustený vo vode.
Predchádzajúce zdôvodnenie sa vzťahuje na akýkoľvek iný kov: Zlatý elektrolytický pokles bude vyžadovať zlaté soli, zvyčajne zlaté kyanidy, ktoré sa môžu stať veľmi toxickými. Niektoré objekty, ako napríklad stravovacie náčinie, môžu byť potiahnuté zlatom, aby sa priradila väčšia hodnota a šľachta.
Ale galvanoplastika presahuje estetiku: sú udelené. Umožňuje tiež šetriť prírodné zdroje, pretože nie je potrebné míňať veľké množstvo kovu na povlaky.
Proces galvanoplastiky
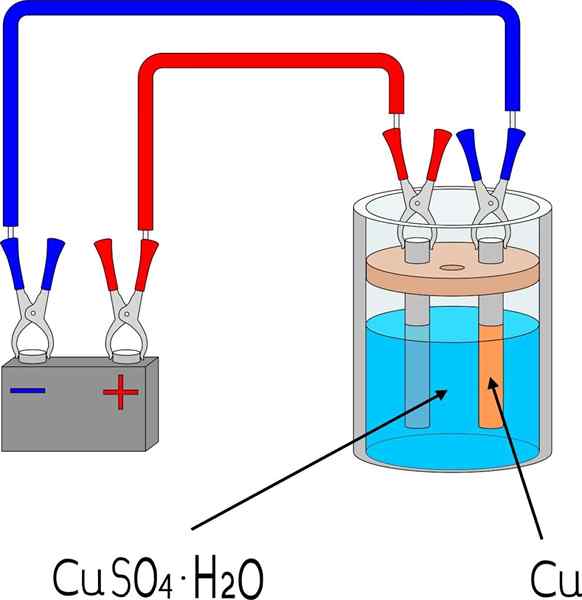 Elektrodepozícia medi v kúpeľni sulfátu medi
Elektrodepozícia medi v kúpeľni sulfátu medi Predmety
Na elektrodepózu kov na povrchu sú potrebné niektoré základné prvky, ktorých rozmery a režim sa budú líšiť v závislosti od šarže predmetov, ktoré sa majú zakryť.
Napríklad na hornom obrázku je znázornená malá medená elektróda, reprodukovateľná v akomkoľvek laboratóriu alebo priestore.
Elektrolytické médium
Po prvé, je potrebné elektrolytové médium kovového až elektrodepositu. Soľ sulfátu medi, cuo4, Je veľmi rozpustný vo vode, takže prináša ióny cu2+ ktoré sa potom zredukujú na atómy cu0. Tieto atómy sú tie, ktoré budú zostavené na prijímajúcom povrchu, aby vznikli kovové kryštály.
Elektrolytické médium je nevyhnutné, aby obvod fungoval a iónové zaťaženie sa môže pohybovať alebo mobilizovať smerom do oblasti, kde sa vyskytuje elektrodepozícia.
Elektróda
Elektródy sú povrchy, na ktorých dochádza k elektrodepozícii z jej chemickej základne. Jednoducho povedané, existujú dve elektródy: katóda, kde je kov elektrodepos; A anóda, kde dochádza k chemickej reakcii, ktorá daruje elektróny kovovým iónom, ktoré pokryjú katódu.
Môže vám slúžiť: uretán: štruktúra, vlastnosti, získanie, použitieTo znamená, že katód sa stáva požadovaným kusom. Medzitým je anóda akýkoľvek povrch, na ktorom druh oxiduje a daruje svoje elektróny katóde. Anóda je mnohokrát vyrobená z toho istého kovu, ktorý sa rozpustí v elektrolytickom prostredí. Ak je v strede medený ión, v tomto prípade bude anóda kovová meď.
Externý obvod
Vonkajší obvod je batéria, ktorá poskytuje počiatočné elektróny, ktoré podporujú elektrodepozíciu. Jeho prítomnosť znamená, že reakcia nie je spontánna: na vytvorenie chemickej zmeny je potrebná elektrina, čo je redukcia rozpustených kovových iónov.
Čistenie elektród
Kus, ktorý má byť zakrytý, musí byť úplne čistý. Inak bude pokovovaný alebo povlak chybný.
Aby ste to dosiahli, musíte sa ubezpečiť, že jeho povrch je úplne hydrofilný, to znamená, že nemá tuk ani nečistoty. Jedným zo spôsobov, ako to zabezpečiť, po chemickom premytí, je navlhčiť kus vodou, a ak sa pozoruje tvorba kvapiek vody alebo nejednotná kvapka kvapaliny, znamená to, že elektróda ešte nie je čistá.
Reakcie a význam elektrónov
Galvanoplastika je redoxná reakcia. Preto: jeden druh sa musí znížiť, zatiaľ čo druhý oxidovaný alebo naopak. V medi máme anódu vyrobenú z medi a katóda vyrobenú z kovu ME (železo, zinok, cín atď.).
Keď zapnete batériu, budú prúdiť elektróny do katódy, ktorá sa začne nabíjať negatívne.
Záporné zaťaženie katódy priťahuje katióny cu2+ elektrolytického prostredia, ktoré sa uskutočnilo redukciou:
Cu2+(Ac) +2e- → Cu (s)
Môže vám slúžiť: Maillardova reakciaBatéria musí obnoviť darované elektróny a ióny cu sa musia obnoviť2+ Znížená, aby sa udržala neutralita elektrolytického prostredia. To je, keď anóda prichádza vo funkcii: Atómy meďnatého oxidujú:
Cu (s) → cu2+(Ac) +2e-
A uvoľnené elektróny sú nasmerované späť na batériu, ktorá ich zase mobilizuje smerom k katóde, aby pokračovala v elektrodepozícii.
Anóda získava pozitívne zaťaženie, ktoré priťahuje ióny SO42- elektrolytického média (znova pozri obrázok).
To znamená, že reakcie, ktoré sa vyskytujú, je redukcia a oxidácia medi, kov, ktorý je elektrodepos:
Cu2+(Ac) +2e- → Cu (s)
Cu (s) → cu2+(Ac) +2e-
Anóda, meď, stráca cesto, zatiaľ čo katód, iného kovu, je pokrytá jemnou medenínskou vrstvou.
Príklady galvanoplastiky
Striebro
Kovy môžu byť „elektrotechnické“, ktoré ich elektrolyticky zakrýva z striebornej vrstvy. To je obzvlášť prospešné v elektronických komponentoch, ktoré musia vykonávať elektrinu. Striebro môže byť elektrodeposita na oceli, meď, nikel a ďalšie kovy.
Poletný
Ckálo je elektrodepozícia cínu. Je to veľmi užitočné pri výrobe železných plechoviek, ktoré sú pokryté cínu, aby boli odolné voči korózii, a preto nepoškodzujú potraviny alebo výrobky, ktoré ukladajú.
Latinčina alebo opálenie
Aj keď trochu komplikovanejšie, mosadz a bronz môžu byť tiež elektrodepos na niektorých kovoch, aby sa zlepšil ich vzhľad.
Zincado
Galvanoplastika zinku alebo zinku (nie je mätúca s tepelnou pozinkovanou) sa väčšinou používa na udelenie odolnosti proti železa voči korózii a jasnejších a atraktívnejších povrchov. Jeho funkcia je teda estetická a zároveň funkčná a nachádza sa v častiach tela, ako sú kolesá.
Kovové plasty
Plasty, ktoré boli predtým ošetrené, aby mali vodivú plochu, môžu byť tiež pokryté kovom, čo je akoby boli prilepené na list hliníkovej fólie.
Môže vám slúžiť: Kitasato bankaAplikácie galvanoplastiky
Aplikácie galvanoplastiky alebo elektrodepozície možno rozdeliť na funkčné alebo estetické.
Funkčný
 Tenké elektrodepos zo zlata v divákoch prípadov astronautov im umožňuje chrániť ich oči pred slnečným žiarením
Tenké elektrodepos zo zlata v divákoch prípadov astronautov im umožňuje chrániť ich oči pred slnečným žiarením Potiahnutie kusu alebo predmetu je poskytnúť jeho povrchu vlastnosti, ktoré samo o sebe chýbajú. Napríklad medená alebo zlatá elektrodpozícia vyrába kusy, ktoré majú, takže je ideálny v elektronických obvodoch na využitie vlastností týchto kovov, bez toho, aby ste museli minúť tony zlata na výrobu celých a pevných kusov.
Na druhej strane zlato chráni povrchy tepla a žiarenia. Z tohto dôvodu sa bežne používa v satelitoch a v prilbách astronautov, pretože odráža slnečné svetlo, a tak predzúta ich oči alebo rýchlo horúco.
Chrome alebo nenápadné ocele sú veľmi odolné voči korózii, vďaka týmto kovovým vrstvám. Preto sa v priemysle používa galvanoplastika na ochranu kovov citlivých na korod.
Estetika
Kovové dýhy žiaria. Na tento účel sa veľmi používajú zinok, nikel a chróm. Zlato a striebro sú tiež elektrodepos v krúžkoch, reťaze, náramkoch, chokeroch, svahoch atď., A preto jej galvanoplastika nájde veľa aplikácií v obchodoch a ozdobách šperkov, aby sa vylepšil obraz a prestíž týchto odevov.
Odkazy
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2021). Elektrotechnický. Zdroj: In.Wikipedia.orgán
- Chris Woodford. (28. júla 2020). Ako funguje elektroplatovanie. Zdroj: Vysvetlenie.com
- Okradnúť Snyder. (s.F.). Elektrodepozícia. STEM Education Institute. [PDF]. Získané z: NanoScale.Unl.Edu
- Elsevier B.Vložka. (2021). Elektrodepozícia. Vedecký. Zdroj: ScienceDirect.com
- Vaishalský mittal. (10. decembra 2020). Elektrotechnický. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- Singh Davneet. (9. júna 2020). Rôzne typy elektroplingu. Získané z: Teachooo.com
- HelMestine, Anne Marie, PH.D. (26. augusta 2020). Čo je to elektroplatovanie a ako to funguje? Zotavené z: Thoughtco.com

