Fosforečnan vápenatého (CA3 (PO4) 2)

- 2955
- 565
- MUDr. Žigmund Boška
On fosfát vápenatého Je to anorganická a terciárna soľ, ktorej chemický vzorec je CA3(PO4)2. Vzorec ustanovuje, že zloženie tejto soli je 3: 2 pre vápnik a fosfát, respektíve. Toto je možné vidieť priamo na spodnom obrázku, kde je zobrazený katión2+ a anión po43-. Za každé tri ca2+ Sú dve po43- Interakcia s nimi.
Na druhej strane, fosfát vápenatého sa týka série solí, ktoré sa líšia v závislosti od pomeru Ca/P, ako aj od stupňa hydratácie a pH. V skutočnosti existuje veľa typov fosfátov vápenatého, ktoré existujú a môžu sa syntetizovať. Po liste sa však nomenklatúra, fosfát vápenatého naráža iba na Tricycal, vyššie uvedený.
 Podiel a ióny v tricárnom fosfáte. Zdroj: Richard-59 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], z Wikimedia Commons
Podiel a ióny v tricárnom fosfáte. Zdroj: Richard-59 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencie/By-SA/3.0)], z Wikimedia Commons Všetky fosfáty vápenatého vrátane CA3(PO4)2, Sú to biele tuhé látky s miernymi šedými tónmi. Môžu byť granulárne, jemné, kryštalické a majú veľkosti častíc, ktoré sú okolo mikrometrov; A boli pripravené aj nanočastice týchto fosfátov, s ktorými sú navrhnuté biokompatibilné materiály pre kosti.
Táto biokompatibilita je preto, že tieto soli sa nachádzajú v zuboch a v krátkych účtoch v tkanivách kostných cicavcov. Napríklad hydroxyapatit je kryštalický fosfát vápenatého, ktorý zase interaguje s amorfnou fázou tej istej soli.
To znamená, že existujú fosfáty amorfných a kryštalických kalciálov. Z tohto dôvodu neprekvapuje rozmanitosť a viac možností pri syntéze materiálov založených na fosforečnanoch vápenatého; Materiály, v ktorých vlastnostiach každý deň majú viac zainteresovaných výskumných pracovníkov na celom svete, aby sa zamerali na obnovenie kostí.
Štruktúra fosfátu vápenatého
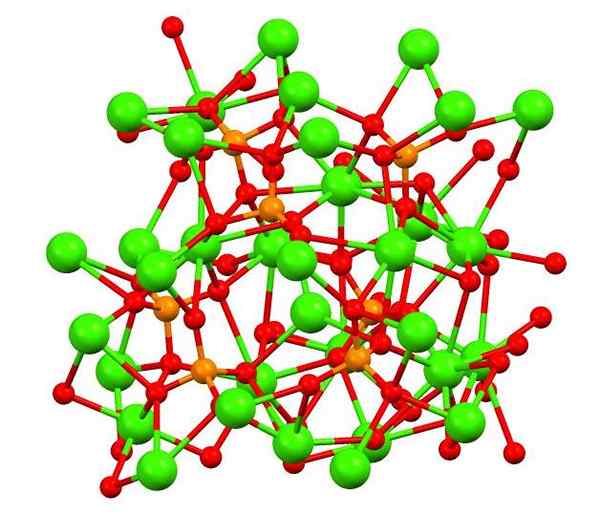 Fosforečnan vápenatého v mineráli Whitlocita. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons
Fosforečnan vápenatého v mineráli Whitlocita. Zdroj: Smokefoot [CC By-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)], z Wikimedia Commons Horný obrázok ukazuje štruktúru kmeňa Kalitného fosfátu v podivnom minerále Whitlockita, ktorý môže obsahovať horčík a železo ako nečistoty.
Aj keď sa na prvý pohľad môže zdať zložitý, je potrebné objasniť, že model predpokladá kovalentné interakcie medzi atómami kyslíka fosfátov a centrámi vápnikového kovu.
Môže vám slúžiť: hydrid berylia (Beh2)Ako reprezentácia je však platná, interakcie sú elektrostatické; to znamená, ca katióny2+ cítiť príťažlivosť pre PO43- (AC2+- O-po33-). S ohľadom na to je zrejmé, prečo sú vápniky v obraze (zelené gule) obklopené negatívne nabitými atómami kyslíka (červené gule).
Ak je toľko iónov, symetrické usporiadanie alebo vzor nezanecháva viditeľné. CA3(PO4)2 prijíma pri nízkych teplotách (t<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, pre svoju skratku v angličtine).
Pri vysokých teplotách sa na druhej strane stáva polymorfom a-CA3(PO4)2 (a-TCP), ktorého jednotková bunka zodpovedá monoklinickému kryštalickému systému. Pri ešte vyšších teplotách je možné vytvoriť aj a'-CA polymorf3(PO4)2, čo je hexagonálna kryštalická štruktúra.
Amorfný fosfát vápenatého
Boli spomenuté kryštalické štruktúry pre fosforečnan vápenatého, čo sa očakáva od soli. To je však schopné zobrazovať.
Ak k tomu dôjde, hovorí sa, že fosfát vápenatého má amorfnú štruktúru (ACP, Amorfný fosfát vápenatého). Niekoľko autorov poukazuje na tento typ štruktúry, ktorá je zodpovedná za biologické vlastnosti CA3(PO4)2 V kostných tkanivách je možné opravy a biomimetizáciu.
Zvyšok rodiny
Fosfáty vápenatého sú v skutočnosti rodinou anorganických zlúčenín, ktoré môžu zase interagovať s organickou matricou.
Ostatné fosfáty sa získajú „jednoducho“ zmenou aniónov, ktoré sprevádzajú vápnik (PO43-, HPO42-, H2Po4-, Oh-), rovnako ako typ nečistôt v pevnej podobe. Až do jedenástich vápnikových alebo viac fosfátov, z ktorých každá má vlastnú štruktúru a vlastnosti, môže byť pôvodne alebo umelo.
Niektoré fosfáty a ich príslušné chemické štruktúry a vzorce budú uvedené nižšie:
-Vodík Dihydrado fosfát vápenatého, CAHPO4∙ 2h2O: Monoklinický.
Môže vám slúžiť: oxalát amónneho-Dihydrogén monohydratovaný fosfát vápenatého, CA (H (H2Po4)2∙ h2O: Triclinic.
-Bezvodý fosfát vo fosforečnanom, CA (h2Po4)2: Triclinic.
-Octacalcifát vodíka (OCP), CA8H2(PO4)6: Triclinic. Je to predchodca v syntéze hydroxyapatitu.
-Hydroxyapatit, ca5(PO4)3Oh: šesťuholník.
Fyzikálne a chemické vlastnosti
Mená
-Fosfát vápenatého
-Fosforečnan Ticalcium
-Triccal difosfát
Molekulová hmotnosť
310,74 g/mol.
Fyzický popis
Je to biela pevná látka.
Príchuť
Bez chuti.
Bod topenia
1670 ° K (1391 ° C).
Rozpustnosť
-Prakticky nerozpustné vo vode.
-Nerozpustný v etanole.
-Rozpustný v kyseline chlorovodíkovej a zriedenej kyseliny dusičnej.
Hustota
3,14 g/cm3.
Index lomu
1629
Štandardná výcvik
4126 kcal/mol.
Úložisko
2-8 ° C.
pH
6-8 vo vodnej suspenzii 50 g/l fosforečnanu vápenatého.
Výcvik
Vápnik a fosfát amónny vodíka a vodíka
Existuje mnoho metód na výrobu alebo tvorbu fosforečnanu vápenatého. Jeden z nich pozostáva zo zmesi dvoch solí, CA (nie3)2∙ 4h2Alebo (nh4)2HPO4, predtým rozpustené v absolútnom alkohole a vode. Jedna soľ prispieva vápnik a druhá fosfát.
Z tejto zmesi ACP vyzráža, ktoré sa potom podlieha zahrievaniu v peci pri 800 ° C a 2 hodiny. V dôsledku tohto postupu sa získa p-CA3(PO4)2. Starostlivo kontrola teplôt, agitácií a kontaktných časov sa môže vyskytnúť tvorba nanokristov.
Na vytvorenie a-CA polymorfu3(PO4)2 Je potrebné zahriať fosfát nad 1000 ° C. Toto otepľovanie sa vykonáva v prítomnosti iných kovových iónov, ktoré tento polymorf stabilizujú dostatočne, aby sa dalo použiť pri teplote miestnosti; to znamená, že zostáva v stabilnom cieľovom stave.
Hydroxid vápenatý a kyselina fosforečná
Fosforečnan vápenatého sa môže tiež tvoriť zmiešaním roztokov hydroxidu vápenatého a kyseliny fosforečnej, ktorá sa vyskytuje neutralizácia kyseliny-bázy. Po pol dni dozrievania v materských duchoch a ich splatnom filtrácii, premytí, sušení a preosiate, granulovaný prach amorfného fosfátu, sa získa ACP.
Tieto reakcie ACP sú produktom vysokých teplôt a transformujú sa podľa nasledujúcich chemických rovníc:
2CA9(HPO4) (Po4)5(OH) => 2CA9(P2Ani7)0,5(PO4)5(Oh) + h2O (a t = 446,60 ° C)
2CA9(P2Ani7)0,5(PO4)5(OH) => 3CA3(PO4)2 + 0,5H2O (a t = 748,56 ° C)
Môže vám slúžiť: selén: História, vlastnosti, štruktúra, získanie, použitieTýmto spôsobom sa získa p-CA3(PO4)2, Váš najbežnejší a najstabilnejší polymorf.
Žiadosti
V kostnom tkanive
CA3(PO4)2 Je to hlavný anorganický zložka kostného popola. Je to súčasť transplantácií na náhradu kostí, ktorá sa vysvetľuje jej chemickou podobnosťou s minerálmi prítomnými v kosti.
Biomateriály fosforečnanu vápenatého sa používajú na korekciu kostných defektov a pri pokrytí kovových protéz. Fosforečnan vápenatý sa na ne ukladá, izoluje ich z prostredia a spomaľuje proces korózie titánu.
Bioceramické cementy
Cement fosforečnanu vápenatého (CPC) je ďalší bioceramika používaná pri opravení kostného tkaniva. Je vypracovaný zmiešaním prachu rôznych typov fosforečnanov vápenatého s vodou, čím sa vytvorí pasta. Cestoviny sa môžu vstreknúť alebo upraviť na kostnú defekt alebo dutinu.
Cementy sú formované, postupne reabsorbované a sú nahradené novovytvorenou kosťou.
Lekári
-CA3(PO4)2 Je to základná soľ, takže sa používa ako antacid na neutralizáciu prebytočnej kyslosti žalúdka a zvýšenie pH. V zubných cestovinách dodáva zdroj vápnika a fosfátu na uľahčenie procesu remineralizácie zubov a kostnej hemostázy.
-Používa sa tiež ako výživový doplnok, hoci najúspornejším spôsobom dodávky vápnika je použitie uhličitanu a citrátu.
-Fosforečnan vápenatý sa môže použiť pri liečbe Tethany, latentnej hypokalciémie a udržiavacej terapie. Okrem toho je užitočný pri suplementácii vápnika počas tehotenstva a dojčenia.
-Používa sa pri liečbe kontaminácie rádioaktívnym izotoposovým rádiom (RA-226) a strontium (SR-90). Fosforečnan vápenatý blokuje absorpciu rádioaktívnych izotopa v tráviacom trakte, čím obmedzuje poškodenie spôsobené nimi.
Ďalší
-Fosforečnan vápenatý sa používa ako krmivo pre vtáky. Okrem toho sa používa v zubných pastoch na kontrolu zborov.
-Používa sa ako anti -gomerantné činidlo, napríklad na zabránenie kompaktu stolovej soli.
-Funguje to ako bieliace činidlo múky. Medzitým v Cochino masle zabraňuje nežiaducemu sfarbeniu a zlepšuje stav vyprážania.
Odkazy
- Fosfát vápenatého. Získané z: pubchem.Ncbi.NLM.NIH.Vláda
- Fosfát vápenatého. Vedecký. Zdroj: ScienceDirect.com

