Štruktúra a funkcie fibronektínu
- 3865
- 524
- Václav Višňovský
Ten fibronektín Je to trieda glykoproteínu, ktorá patrí do extracelulárnej matrice. Tento typ proteínu je zvyčajne zodpovedný za väzbu alebo prepojenie bunkovej membrány s kolagénovými vláknami nájdenými vonku.
Názov „fibronektín“ pochádza zo slova zloženého z dvoch slov v latinčine, prvé je “vláknina čo znamená vlákno alebo vlákno a druhé "Necter" Čo znamená spojenie, prepojenie, pastu alebo flirtovanie.
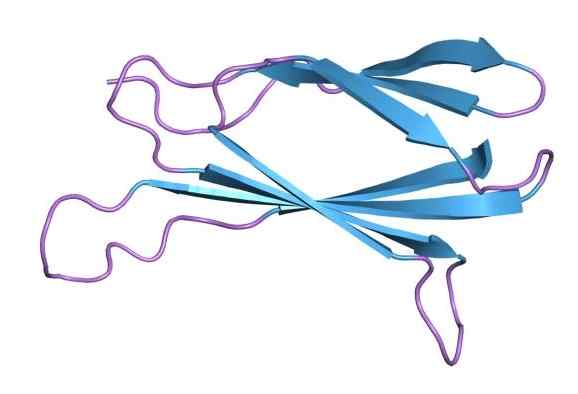
 Molekulárna štruktúra fibronektínu (zdroj: Jawahar Swaminathan a MSD zamestnanci v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons)
Molekulárna štruktúra fibronektínu (zdroj: Jawahar Swaminathan a MSD zamestnanci v Európskom bioinformatickom inštitúte [verejná doména] prostredníctvom Wikimedia Commons) Fibronektín bol prvýkrát vizualizovaný v roku 1948 ako fibrinogénna znečisťujúca látka pripravená procesom frakcionácie frakcionácie CoHn Cold Etanol. Toto bolo identifikované ako jedinečný plazmatický glykoproteín, ktorý mal charakteristiky chladného nerozpustného globulínu.
Tento proteín má vysokú molekulovú hmotnosť a súvisí so širokou škálou funkcií vo vnútri tkanív. Medzi nimi je adhézia medzi bunkami a bunkami, organizácia cytoskeletu, onkogénna transformácia, okrem iného.
Fibronektín je distribuovaný mnohými časťami tela prostredníctvom rozpustnej formy v krvnej plazme, mozgovomiechovom moku, synoviálnej tekutine, amniotickej tekutine, semennej tekutine, slín a zápalom exsuduje.
Vedci uviedli, že plazmatické koncentrácie fibronektínu stúpajú, keď tehotné ženy trpia predplalasiou. Toto zvýšenie koncentrácie fibronektínu teda boli začlenené špecialistami na diagnostiku pacientov uvedený stav.
[TOC]
Štruktúra
Fibronektíny sú veľké glykoproteíny, ktoré majú molekulovú hmotnosť približne 440 kDa. Sú zložené z asi 2.300 aminokyselín, ktoré predstavujú 95% proteínu, pretože ostatných 5% sú uhľohydráty.
Môže vám slúžiť: Enterokromofinácie bunky: histológia, funkcie, chorobyRôzne analýzy, ktoré sa vykonali na genomickej a transkriptomickej sekvencii (Messenger RNA) proteínu, naznačili, že sa skladá z troch blokov opakovaných homológnych sekvencií s dĺžkou 45, 60 a 90 aminokyselín.
Tri typy sekvencií tvoria viac ako 90% celkovej štruktúry fibronektínov. Homológne sekvencie typu I a II sú slučky spojené medzi sebou pomocou disulfidových mostov. Tieto slučky obsahujú 45 a 60 aminokyselinový odpad, každý, respektíve.
Homológne sekvencie typu III zodpovedajú 90 aminokyselinám usporiadaným v lineárnom a bez disulfurových mostov vo vnútri. Niektoré z vnútorných aminokyselín homológnych sekvencií typu III majú však voľné sulfidové skupiny (R-S-H).
Tri homológne sekvencie sa skladajú a organizujú sa vo viac alebo menej lineárnej matrici za vzniku dvoch „dimických ramien“ takmer identických proteínových podjednotiek. Rozdiely medzi týmito dvoma podjednotkami vyplývajú z post-transcriptívnych udalostí dozrievania.
Fibronektíny sa dajú všeobecne pozorovať dvoma spôsobmi. Otvorený tvar, ktorý sa pozoruje pri ukladaní na povrch membrány a ktorý je pripravený prepojiť niektoré ďalšie zložky exteriéru buniek. Táto forma je pozorovaná iba elektronickou mikroskopiou.
Iný spôsob je možné vidieť vo fyziologických riešeniach. Konce každej ramena alebo predĺženia sú ohnuté smerom k stredu proteínu a spájajú sa karboxylovými koncami kolagénových väzbových miest. Týmto spôsobom má proteín guľový vzhľad.
Domény a vlastnosti „multiadhesie“
Freibonektínové multiadhesionálne vlastnosti pochádzajú z dôvodu prítomnosti rôznych domén, ktoré majú vysoké afinitné hodnoty pre rôzne substráty a proteíny.
Môže vám slúžiť: membránové receptory: funkcie, typy, ako fungujú„Dimérica Arms“ možno rozdeliť do 7 rôznych funkčných domén. Tieto sú klasifikované podľa substrátu alebo domény, ku ktorej sa každý z nich pripojí. Napríklad: doména 1 a doména 8 sú doménami spojenia s fibrínovým proteínom.
Doména 2 má vlastnosti väzby na kolagén, doména 6 je oblasť bunkovej adhézie, to znamená, že umožňuje ukotviť takmer v akejkoľvek membráne alebo vonkajšom povrchu buniek. Funkcie domén 3 a 5 sú dnes stále neznáme.
V doméne 9 je karboxyl alebo C-terminálny koniec proteínu umiestnený. Oblasti adhézie MAM DOMAIN 6 Bunky majú tripéptid tvorený arginín-glycín-asparagínovými aminokyselinami (ARG-Gly-ASP).
Tento výlet je zdieľaný niekoľkými proteínmi, ako sú kolagén a integríny. To isté je minimálna štruktúra potrebná na rozpoznávanie plazmatickej membrány fibronektínmi a integrinmi.
Fibronektín, keď je vo svojej guľovej podobe, predstavuje rozpustnú a voľnú formu v krvi. Avšak na bunkových povrchoch av extracelulárnej matrici je v „otvorenej“, tuhej a nerozpustnej forme.
Funkcia
Niektoré z procesov, v ktorých je účasť fibronektínov spojením buniek do buniek, spojením, spojením alebo pri adhézii bunky s plazmou alebo bazálnymi membránami, stabilizáciou krvných zrazenín a hojením rany.
Bunky priľnujú k špecifickému miesta vo fibronektíne prostredníctvom prijímajúceho proteínu známeho ako „integrín“. Tento proteín prechádza plazmatickou membránou do vnútra bunky.
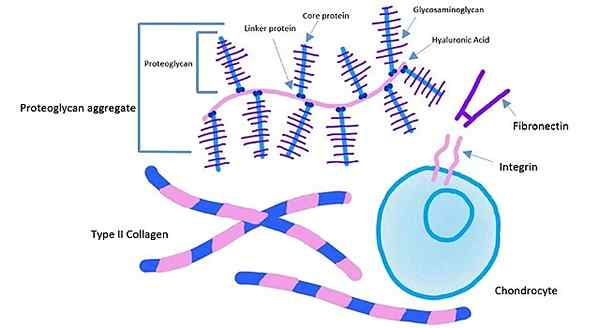 Komponenty extracelulárnej matrice chrupavkového tkaniva (zdroj: kassidy veasaw [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons)
Komponenty extracelulárnej matrice chrupavkového tkaniva (zdroj: kassidy veasaw [CC BY-SA 4.0 (https: // creativeCommons.Org/licencie/By-SA/4.0)] Via Wikimedia Commons) Extracelulárna doména integrínov sa viaže na fibronektín, zatiaľ čo intracelulárna doména integrínov je dodržiavaná na aktínové vlákna. Tento typ kotvy vám umožňuje vysielať napätie generované v extracelulárnej matrici do cytoskeletu buniek.
Môže vám slúžiť: smozým: Charakteristiky, štruktúra, funkcieFibronectinas sa zúčastňujú procesu hojenia rany. Tieto sú vo svojej rozpustnej podobe uložené na kolagénové vlákna susediace s ranom, pomáhajú migrácii fagocytov, fibroblastov a proliferácie buniek v otvorených ranách.
Skutočný proces hojenia sa začína, keď fibroblasty „otočia“ sieť fibronektínu. Táto sieť pôsobí ako druh lešenia alebo podpory nových kolagénových vlákien, ktoré sa majú uložiť, sulfát Heparán, Proteoglican.
Fibronektín sa tiež podieľa na pohybe epidermálnych buniek, pretože prostredníctvom granulovaného tkaniva pomáha reorganizovať bazálnu membránu pod epidermis v tkanivách, čo pomáha vyskytovať keratinizáciu.
Všetky fibronektíny majú nevyhnutné funkcie pre všetky bunky; Zúčastňujú sa na procesoch tak rozmanitých ako migrácia a diferenciácia buniek, homeostáza, fagocytóza hojenia rán.
Odkazy
- Conde-Agudelo, a., Romero, r., & Roberts, J. M. (2015). Testy na predpovedanie preeklampsie. V Chesleyho hypertenzných poruchách v tehotenstve (s. 221-251). Akademická tlač.
- Farfán, J. Do. L., Tovar, h. B. Siež., chôdze, m. D. R. G., & Guevara, C. G. (2011). Fetálny fibronektín a dĺžka krčka maternice ako skoré prediktory predčasného dodania. Gynekológia a pôrodníctvo v Mexiku, 79 (06), 337-343.
- Feist, e., & Hiepe, f. (2014). Autoprotilátky fibronektínu. V autoantiláciách (str. 327-331). Elsevier.
- Letourneau, str. (2009). Axonálna dráha: Extracelulárna úloha matíc. Encyclopedia of Neuroscience, 1, 1139-1145.
- Pankov, R., & Yamada, K. M. (2002). Fibronektín na prvý pohľad. Journal of Cell Science, 115 (20), 3861-3863.
- Proctor, R. Do. (1987). Fibronektín: Stručný prehľad jeho štruktúry, funkcie a fyziológie. Recenzie infekčnej ľahkosti, 9 (doplnok_4), S317-S321.
- « Condroblasty Charakteristiky a funkcie
- Charakteristiky topo grillo, biotop, distribúcia, plavby, kontrola »

