Charakteristiky a príklady polárneho kovalentného spojenia
- 2883
- 294
- Valentín Dula
A Polárny kovalent Je to také vytvorené medzi dvoma chemickými prvkami, ktorých rozdiel elektronegativity je podstatný, ale bez toho, aby sa priblížil k čisto iónovému charakteru. Je to teda stredná silná interakcia medzi apolárnymi kovalentnými väzbami a iónovými väzbami.
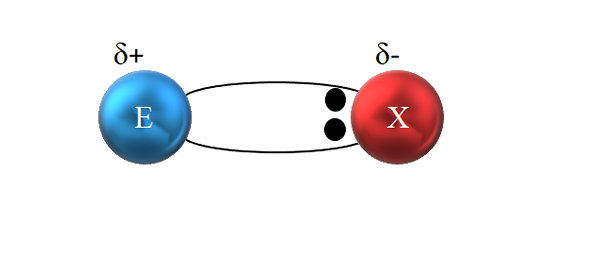
Hovorí sa, že je kovalentný, pretože teoreticky existuje spravodlivé zdieľanie elektronického páru medzi týmito dvoma prepojenými atómami; to znamená, že dva elektróny sa zdieľajú rovnako. Atom E · daruje elektrón, zatiaľ čo · x poskytuje druhý elektrón na vytvorenie kovalentnej väzby E: X alebo E-X.
 V polárnej kovalentnej väzbe nie je zdieľaný rovnomerne pár elektrónov. Zdroj: Gabriel Bolívar.
V polárnej kovalentnej väzbe nie je zdieľaný rovnomerne pár elektrónov. Zdroj: Gabriel Bolívar. Ako je však vidieť na vynikajúcom obraze, dva elektróny nie sú umiestnené v strede E a X, čo naznačuje, že „cirkulujú“ s rovnakou frekvenciou medzi oboma atómami; ale sú bližšie k X ako e. To znamená, že X prilákala dvojicu elektrónov pre seba kvôli svojej väčšej elektronegativite.
Byť elektrónmi spojenia bližšie k X ako E, vytvára sa okolo x oblasť s vysokou elektronickou hustotou, δ-; Zatiaľ čo v E sa v elektronoch objavuje zlá oblasť, δ+. Preto existuje polarizácia elektrických nábojov: polárne kovalentné puto.
[TOC]
Charakteristika
Polarita
Kovalentné putá sú svojou povahou veľmi hojné. Sú prakticky prítomné vo všetkých heterogénnych molekulách a chemických zlúčeninách; pretože koniec koncov sa tvorí, keď sú spojené dva rôzne atómy E a X. Existuje však viac polárnych kovalentných dlhopisov ako ostatné a aby ste zistili, že sa musíte uchýliť k elektronickým orgánom.
O čo viac elektronegatívne je x a menej elektronegatívne e e (elektropozitívne), potom výsledná kovalentná väzba bude polárnejšia. Konvenčný režim na odhad tejto polarity je prostredníctvom vzorca:
Môže vám slúžiť: Borohydrid sodný (NABH4): Štruktúra, vlastnosti, použitiahrebeňX - hrebeňA
Kde χ je elektronegativita každého atómu podľa Pauling Scale.
Ak má toto odčítanie alebo odčítanie hodnoty medzi 0,5 a 2, potom to bude polárne spojenie. Preto je možné porovnávať stupeň polarity medzi niekoľkými odkazmi E-X. V prípade, že získaná hodnota je vyššia ako 2, hovorí sa o iónovom spojení a+X- A nie je toΔ+-XΔ-.
Polarita spojenia E-X však nie je absolútna, ale závisí od molekulárnych prostredí; To znamená v molekule -e-x-, kde E a X tvoria kovalentné väzby s inými atómami, druhý priamo ovplyvňuje tento stupeň polarity.
Chemické prvky, ktoré ich vznikajú
Zatiaľ čo E a X môžu byť akýmkoľvek prvkom, nie všetci pochádzajú z polárnych kovalentných väzieb. Napríklad, ak je e vysoko elektropozitívny kov, ako je alkalický (Li, Na, K, RB a CS) a x halogénu (F, Cl, Br a I), budú mať tendenciu tvoriť iónové zlúčeniny (NA+Cl-) a nie molekuly (Na-Cl).
Preto sú polárne kovalentné väzby zvyčajne medzi dvoma nemetalickými prvkami; av menšej miere, medzi nemetalickými prvkami a niektorými prechodnými kovmi. Vidieť blok p Z periodickej tabuľky existuje veľa možností na vytvorenie tohto typu chemických spojení.
Polárny a iónový charakter
Vo veľkých molekulách nie je dôležité premýšľať o tom, aký je polárny spojenie; Sú vysoko kovalentné a distribúcia ich elektrických nábojov (kde sú bohaté alebo chudobné regióny elektrónov), je väčšia pozornosť pri definovaní stupňa kovalencie ich vnútorných väzieb.
Môže vám slúžiť: plynová chromatografiaS diatomickými alebo malými molekulami, uviedla polarita aΔ+-XΔ- Je to celkom relatívne.
Toto nie je problém s molekulami vytvorenými medzi nemetalickými prvkami; Ale keď sa zúčastnia prechody alebo metaloidné kovy, už sa nehovorí iba o polárnom kovalentnom zväzku, ale o kovalentnom zväzku s určitým iónovým charakterom; a v prípade prechodných kovov kovalentné koordinačné spojenie vzhľadom na jeho povahu.
Príklady polárnych kovalentných väzieb
Co
Kovalentná väzba medzi uhlíkom a kyslíkom je polárna, pretože prvá je menej elektronegatívna (χC = 2,55), že druhý (χAni = 3,44). Preto, keď vidíme odkazy c-o, c = o o c-o-, Budeme vedieť, že sú to polárne odkazy.
H-x
Halogenidy vodíka, HX, sú ideálnymi príkladmi na pochopenie polárnej väzby v ich diatomických molekulách. Mať vodíkovú elektronegativitu (χH = 2,2), môžeme odhadnúť, aké polárne sú tieto halogenurky:
-HF (H-F), χF (3,98) - χH (2,2) = 1,78
-Hcl (h-cl), χCl (3,16) - χH (2,2) = 0,96
-HBR (H-BR), χBr (2,96) - χH (2,2) = 0,76
-Ahoj (h-i), χJo (2,66) - χH (2,2) = 0,46
Všimnite si, že podľa týchto výpočtov je odkaz H-F najviac polárnym zo všetkých. Teraz je jeho iónová postava vyjadrená ako percento, ďalšou témou. Tento výsledok nie je prekvapujúci, pretože fluór je najviac elektronegatívny prvok zo všetkých.
Keď elektronegativita zostupuje z chlóru na jód, odkazy H-Cl, H-B a H-I sa stávajú menej polárnymi. Link H-I by mal byť apolar, ale v skutočnosti je polárny a tiež veľmi „krehký“; ľahko sa zlomí.
Môže vám slúžiť: Merkúrový hydroxid: Štruktúra, vlastnosti, použitie, rizikáO-h
Polárny O-H odkaz môže byť najdôležitejší zo všetkých: Vďaka mu je život, pretože spolupracuje s dipólovým momentom vody. Ak odhadneme rozdiel medzi elektrónmi kyslíka a hydrogénov, budeme mať:
hrebeňAni (3,44) - χH (2,2) = 1,24
Avšak molekula vody, h2Alebo má dva z týchto odkazov, H-O-H. Táto a uhlová geometria molekuly a jej asymetria z nej robí vysoko polárnu zlúčeninu.
N-h
N-H spojenie je prítomné v aminoskupinách proteínov. Opakovanie toho istého výpočtu, aký máme:
hrebeňN (3,04) - χH (2,2) = 0,84
Odráža to, že N-H spojenie je menej polárne ako O-H (1,24) a F-H (1,78).
Škodlivý
Spojenie Fe-O je dôležité, pretože ich oxidy sa nachádzajú v mineráloch železa. Uvidíme, či je viac polárne ako H-O:
hrebeňAni (3,44) - χVernosť (1,83) = 1,61
Odtiaľ je správne predpokladané, že odkaz Fe-O je viac polárny ako odkaz H-O (1,24); Alebo to, čo je to isté ako povedať: Fe-O má väčší iónový charakter ako H-O.
Tieto výpočty slúžia na objavovanie stupňov polarity medzi niekoľkými väzbami; Ale nestačia na to, aby rozhodli, či je zlúčenina iónová, kovalentná alebo jej iónový charakter.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- Laura Nappi. (2019). Polárne a nepolárne kovalentné väzby: definície a príklad. Štúdium. Získané z: štúdie.com
- HelMestine, Anne Marie, PH.D. (18. september 2019). Definícia a príklad polárneho dlhopisu (polárna kovalentná väzba). Zotavené z: Thoughtco.com
- Elsevier B.Vložka.(2019). Polárny kovalent. Vedecký. Zdroj: ScienceDirect.com
- Wikipedia. (2019). Chemická polarita. Zdroj: In.Wikipedia.orgán
- Anonymný. (5. júna 2019). Vlastnosti polárnych kovalentných väzieb. Chémia librettexts. Získané z: Chem.Librettexts.orgán

