Kovalentná väzba
- 4528
- 1267
- Alan Milota
Čo je kovalentné spojenie?
Kovalentná väzba je silná interakcia, ktorá umožňuje spojenie dvoch alebo viacerých atómov pri vytváraní molekúl. Toto je jeden z typov chemických väzieb, na ktorých sa zúčastňuje niekoľko elektrónov, ktoré pochádzajú z najvzdialenejších orbitálov atómov, ktoré sú spojené.
Teoreticky každý atóm prispieva k jednému z dvoch elektrónov pri spájaní kovalentných, aby vyhrali stabilitu. Pár elektrónov, ktorý sa stáva akýmsi „elektronickým hákom“ medzi dvoma atómovými jadrami, sa zdieľa rovnako medzi dvoma rovnakými atómami, ale nestane sa to, keď sú tieto dva atómy z dvoch rôznych prvkov.
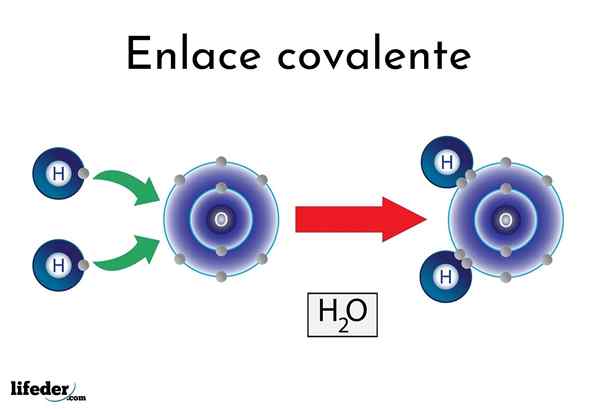
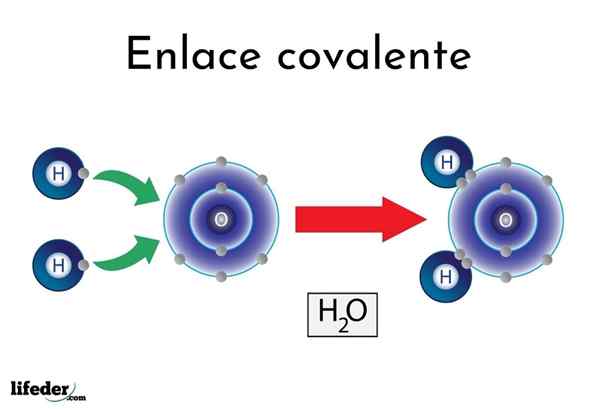 Kovalentná väzba
Kovalentná väzba Existujú atómy alebo prvky, ktoré majú prirodzenú tendenciu poskytovať elektróny, zatiaľ čo iní ich uprednostňujú, aby ich vyhrali.
Napríklad slávna molekula vody, h2Alebo má dve kovalentné odkazy: H-O-H. Hydrogény a kyslík zdieľajú dva páry elektrónov, ale tieto obežné dráhy bližšie k atómu kyslíka ako vodík. Tento jav je spôsobený polaritou a elektronegativitou.
Charakteristiky kovalentných väzieb
Kovalentné väzby predstavujú tieto charakteristiky:
-Zahŕňajú niekoľko elektrónov pre každú kovalentnú väzbu.
-Jeho dĺžky sa zvyčajne vyjadrujú v jednotkách PM (pikometre) alebo v jednotkách Armstrong (A).
-Je ťažké ich zlomiť, čo znamená, že sú veľmi silné.
-Keď sa zlomia, vyskytnú sa chemické zmeny alebo transformácie, pretože molekula stráca atómy. V tomto procese je energia absorbovaná.
-Keď sa vytvoria, rodí sa nová molekula. V tomto procese sa uvoľňuje energia.
Môže vám slúžiť: Chemické reakcie: Charakteristiky, časti, typy, príklady-Jeho dĺžky sa líšia v závislosti od avidity, ktorú má jeden z prepojených atómov smerom k páru elektrónov; To znamená, že čím viac ho priťahuje, kovalentné spojenie sa predlžuje.
-Najjednoduchšie kovalentné väzby existujú iba medzi dvoma atómami súčasne a sú zastúpené skriptom alebo riadkom (-).
Existujú aj ďalšie funkcie, ktoré sa vzťahujú na zložitejšie kovalentné odkazy, ktoré však tiež zodpovedajú tomu, čo je uvedené vyššie.
Typy kovalentných odkazov
Kovalentné väzby možno v zásade klasifikovať dvoma spôsobmi: podľa počtu zdieľaných elektrónov a podľa výslednej polarity pri tvorbe molekuly. Obidve budú opísané povrchne nižšie.
Podľa počtu zdieľaných elektrónov
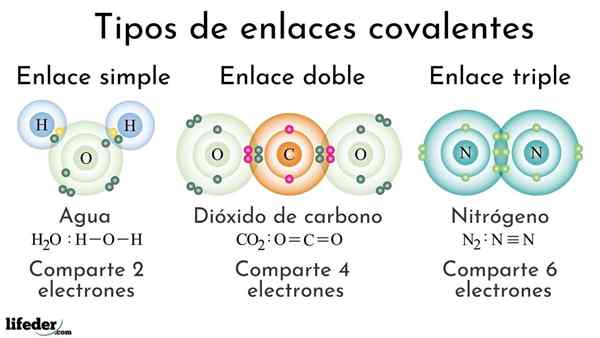 Typy kovalentných dlhopisov podľa počtu zdieľaných elektrónov
Typy kovalentných dlhopisov podľa počtu zdieľaných elektrónov Kovalentné dlhopisy podľa počtu zdieľaných elektrónov možno klasifikovať ako jednoduché, dvojité alebo trojnásobné. Na hornom obrázku sú uvedené tieto príslušné odkazy pre tri molekuly, ktoré budú uvedené nižšie.
-
Jednoduchý
Jednoduchá kovalentná väzba je taká, v ktorej existuje iba niekoľko elektrónov, to znamená dva elektróny. Príklad tohto odkazu, ktorý vidíme v molekule vody, h2Ani. Všimnite si, že zo všetkých kovalentných väzieb, jednoduché, i-i, je najdlhší zo všetkých. Toto je takmer vždy.
-
Zdvojnásobiť
V dvojitej kovalentnej väzbe máme, ako už názov napovedá, dva páry elektrónov, čo znamená, že existujú štyri elektróny, ktoré posilňujú „elektronický háčik“ medzi týmito dvoma prepojenými atómami.
To znamená, že dvojitá väzba (=) je silnejšia ako jednoduchá (-). Je to však reaktívnejšie, čo sa však môže zdať protichodné, je ľahké vysvetliť vzhľadom na prekrývanie atómových orbitálov.
Môže vám slúžiť: Polarita (chémia): Čo je, definícia, príkladyPríklad tohto spojenia je vidieť v molekule oxidu uhličitého, CO2. Dva atómy kyslíka zostávajú silne spojené s uhlíkom vďaka tejto väzbe alebo = C = O, ktoré, za silnejšie, bližšie k atómom; A to vedie k skráteniu odkazu.
-
Trojnásobok
Triple Link je najsilnejší a najkratší z kovalentných väzieb (spoločné). Všimnite si, že pre molekulu dusíka, n2 alebo n≡n, ich atómy predstavované modrami guľami sú veľmi blízko k sebe.
V trojnásobnom spojení máme tri elektrónové páry, ktoré sa rovnajú šiestim elektrónom, ktoré posilňujú kovalentnú väzbu medzi týmito dvoma atómami.
-
Dativý
Dative Link je špeciálny typ jednoduchého spojenia, ktorý pozostáva z páru elektrónov, pochádza iba z jedného z dvoch prepojených atómov. To znamená, že by sa dalo považovať za „nútené zdieľanie“.
Napríklad M molekula m2Alebo použite jeden z párov bez kyslíka na ich darovanie Ion H+ (H2O: → H+ = [H2O-h]+ alebo h3Ani+).
Podľa polarity
Kovalentné väzby podľa polarity možno klasifikovať ako polárny kovalentný alebo ne -polárny kovalent.
-
Polárne kovalentné väzby
Vyskytuje sa medzi dvoma rôznymi atómami, ktorých rozdiel elektronegativity je veľký. To má za následok tvorbu dipólu, kde sa atóm koncentruje negatívne (priťahuje elektróny), zatiaľ čo ostatné koncentráty pozitívne (poskytujú elektróny). Napríklad kovalentná väzba HF (H-F) je polárna, pretože fluorid je viac elektronegatívny ako vodík.
-
Nepolárne kovalentné odkazy
Vyskytuje sa medzi dvoma rovnakými atómami, ktorých rozdiel v elektronickejpativite je nula alebo veľmi malý. Vyššie uvedené molekuly: i2, Ani2 a n2 Predstavujú nepolárne kovalentné väzby. Preto sú elektróny okolo oboch atómov s rovnakou frekvenciou.
Môže vám slúžiť: uretán: štruktúra, vlastnosti, získanie, použitiePríklady kovalentných odkazov
Nakoniec budú uvedené ďalšie kovalentné dlhopisy okrem tých, ktoré už boli vysvetlené, čo tiež naznačuje ich typy:
H2S (H-S-H), jednoduchý polárny kovalent | HCl (H-Cl), polárny jednoduchý kovalentný odkaz |
H2 (H-H), nie polárny jednoduchý kovalent | C2H4 (H-C≡C-h), s dvoma jednoduchými polárnymi odkazmi (C-H) a trojitým nepolárnym odkazom (C≡C) |
F2 (F-F), jednoduchý nepolárny kovalent | P2 (P≡P), nepolárne (alebo apolárne) kovalentné väzby |
Co₂ (o = c = o), dvojité polárne kovalent | S2 (S = S), ne -polárna dvojitá väzba |
HCN (H-C≡N), s jednoduchou polárnou kovalentnou väzbou (H-C) a ďalším trojitým polárnym odkazom (C≡N) | NH3 (N-H), s tromi jednoduchými polárnymi kovalentnými väzbami |
Citované príklady zodpovedajú malým molekulám. Kovalentné väzby sú však prítomné vo všetkých existujúcich molekulách vrátane polymérov, biomolekúl, makromolekulov, minerálov, keramiky, uhľovodíkov.
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Triasť a Atkins. (2008). Anorganická chémia. (Štvrté vydanie). MC Graw Hill.
- María estela Raffino. (28. júna 2020). Kovalentná väzba. Koncepcia.z. Získané z: koncepcie.z
- Wikipedia. (2020). Kovalentná väzba. Zdroj: In.Wikipedia.orgán
- Camy Fung & Nima Mirzaee. (15. augusta 2020). Kovalentné väzby. Chémia librettexts. Získané z: Chem.Librettexts.orgán
- HelMestine, Anne Marie, PH.D. (27. augusta 2020). Čo je kovalentná väzba v chémii? Zotavené z: Thoughtco.com

