Aktivačná energia

- 4599
- 312
- Mgr. Pravoslav Mokroš
Vysvetlíme, aká je aktivačná energia, jej vzorec, jednotky, ako sa vypočítava a uvádzame niekoľko príkladov
Čo je aktivačná energia?
Ten aktivačná energia (Ado) Je definovaná ako minimálna energia potrebná na vykonanie chemickej reakcie. Inými slovami, je potrebné prekonať energetickú bariéru, aby sa reagencie mohli stať výrobkami.
Aktivačná energia je možné vidieť v akcii v každodennom živote. Skutočne vieme, že pri otváraní kľúča plynového priechodu v kuchyni sa okamžite nespáli, keď príde do kontaktu so vzduchom.
Aby začína spaľovacia reakcia, je potrebné poskytnúť iskru alebo oheň zápasu. Táto iskra alebo tento oheň predstavuje aktivačnú energiu spaľovacej reakcie.
Prečo je potrebná aktivačná energia?
Aby sme pochopili dôvod, prečo reakcie potrebujú, aby sa vyskytla minimálna energia, je dôležité pochopiť, ako sa vyskytujú. Pre dva atómy alebo molekuly, aby reagovali, sa musia najprv zraziť. Okrem toho to musia urobiť so správnou orientáciou, aby sa mohli vytvoriť nové chemické väzby a starí ľudia sa môžu zlomiť.
Avšak aj keď sú tieto dve molekuly smerované k sebe s dokonalou orientáciou, nezabezpečuje to, aby bola poskytnutá účinná kolízia v dôsledku odporu medzi elektrónmi povrchu molekúl.
Z tohto dôvodu je potrebné, aby sa molekuly okrem správnej orientácie pohybovali aj s určitou rýchlosťou alebo s určitou minimálnou kinetickou energiou, ktorá zaisťuje, že zrážka je dostatočne silná na to, aby pôsobila proti odporu elektrónov.
Táto minimálna kinetická energia potrebná na mikroskopickej úrovni je tá, ktorá sa premieta do reakčnej aktivačnej energie.
Môže vám slúžiť: lítiumbromid: Štruktúra, vlastnosti, použitie, rizikáČo je vidieť v energetickom diagrame?
Energetický diagram je grafická reprezentácia, ktorá ukazuje, ako sa energia reagencií mení, keď sa transformujú na výrobky. V týchto diagramoch, ako je napríklad tie uvedené nižšie, je ľahké vidieť a interpretovať aktivačnú energiu.

V tomto grafe modrá čiara ukazuje energiu v priebehu reakcie. Tu vidíte, že ak chcete stať sa výrobkami, reagencie musia najprv prekonať kopec, aby dosiahol prechodný stav. Inak sa vrátia do svojho počiatočného stavu.
Výška tohto kopca je presne aktivačná energia. Ak je možné prekonať, zvyšok cesty je z kopca a činidlá sa rýchlo stanú výrobkami.
Aktivačné energetické jednotky
Aktivačná energia je intenzívna veľkosť, ktorá je vyjadrená v energetických jednotkách nad hmotnosťou alebo krtkami. Pretože existujú rôzne energetické jednotky a rôzne hmotnostné jednotky, aktivačná energia je možné vyjadriť v niekoľkých rôznych jednotkách. Avšak najčastejšie používané v chémii sú:
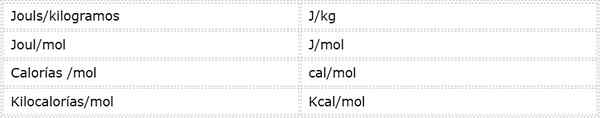
Ktorá jednotka sa používa, závisí od údajov, z ktorých sa vypočítava, alebo od použitia, ktoré sa budú konať v iných výpočtoch.
Aktivačná energia
Aktivačná energia súvisí s reakčnou rýchlosťou. V skutočnosti, čím väčšia je aktivačná energia, tým nižšia je rýchlosť. Tento vzťah sa matematicky vyjadruje prostredníctvom Arheniusovej rovnice, ktorá súvisí s rýchlosťou reakcie na teplotu.
Môže vám slúžiť: Benedikt Reagent: Na čo je to, komponenty, príprava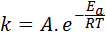
V tejto rovnici, klimatizovať Je to rýchlostná konštanta reakcie ado Je to aktivačná energia, r je konštanta ideálnych plynov, t je absolútna teplota a nazýva sa predbinenciálny faktor Arrhenius, ktorý sa tiež nazýva kolízny faktor.
Táto rovnica môže byť preusporiadaná tak, aby poskytla:
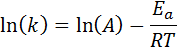
Ak je hodnota A pre reakciu známa, potom sa aktivačná energia môže získať vyčistením predchádzajúcej rovnice. Toto však nie je spôsob, akým sa zvyčajne určuje aktivačná energia reakcie. Normálne sa rýchlostná konštanta určuje pri dvoch alebo viacerých teplotách, vďaka čomu je zbytočné vedieť.
Ako sa počíta aktivačná energia?
Aktivačná energia je určená z hodnôt rýchlosti konštanty pri rôznych teplotách. Najmenej dve hodnoty klimatizovať merané pri rôznych hodnotách T na výpočet aktivačnej energie bez toho.
V závislosti od toho, koľko hodnôt klimatizovať Majú, môžete vypočítať ado Dvoma spôsobmi:
1. Keď máš klimatizovať pri dvoch teplotách
V týchto prípadoch je ľahšie začať od prvej formy Arrheniusovej rovnice. Ak zavoláme klimatizovať1 na rýchlosť konštanty pri teplote Tón1 a klimatizovať2 na rýchlosť konštanty pri teplote Tón2, Potom môžeme napísať Arrheniusovu rovnicu dvakrát:
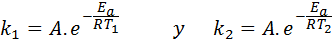
Teraz môžeme rozdeliť niektorú z týchto dvoch rovníc medzi druhou, aby sme zrušili::
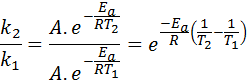
Potom, keď vezmete Neperian Logaritmus na oboch stranách a riešenie pre edo, je získané:
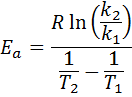
2. Keď máš klimatizovať Viac ako dve teploty
V prípadoch, keď existuje niekoľko stanovení rýchlosti konštanty pri rôznych teplotách, je lepšie nájsť aktivačnú energiu graficky alebo pomocou lineárnej regresie. Je to založené na rovnici v logaritmickej forme, ktorá má tvar riadku:
Môže vám slúžiť: Clausius-Clapeyronova rovnica: Na čo ide, príklady, cvičenia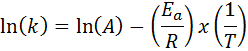
Ak vytvoríme graf LN (k) verzus (1/t), získame priamu čiaru, ktorá sa zníži na osi a v LN (a) a ktorého sklon sa rovná -(edo/R). Odtiaľ sa získa aktivačná energia.
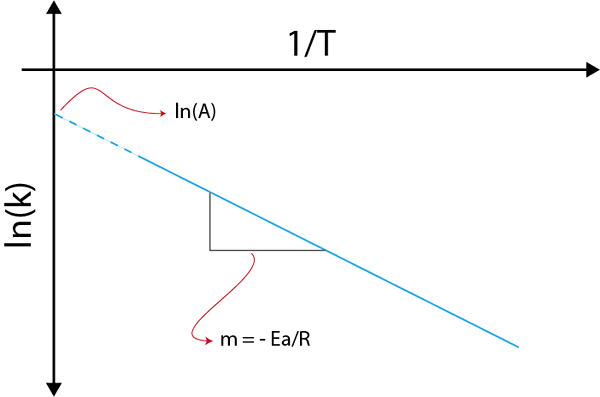 Graf Arrhenius na určenie aktivačnej energie
Graf Arrhenius na určenie aktivačnej energie Príklady výpočtu aktivačných energií
Príklad 1
Rýchlostná konštanta reakcie prvého riadku bola stanovená pri dvoch rôznych teplotách. 298 K malo hodnotu 0.058 s-1, zatiaľ čo pri 350 K sa hodnota zvýšila na 0,425 s-1. Stanovte aktivačnú energiu tejto reakcie v J/mol.
- Riešenie: Pretože máte konštantu pri dvoch teplotách, vzorec aktivačnej energie uvedený vyššie sa môže použiť priamo. Keď sa energia požaduje v jednotkách J/MOL, musíme v týchto jednotkách použiť plynnú konštantu:
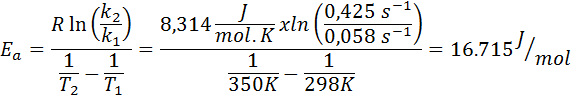
Príklad 2
Rýchlostná konštanta pre druhú chemickú reakciu sa meria pri rôznych teplotách. Hodnoty sú uvedené v nasledujúcej tabuľke. Stanovte aktivačnú energiu v KCAL/MOL.
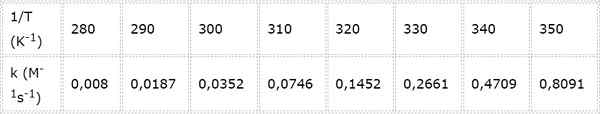
- Riešenie: Rovnako ako v tomto prípade existuje niekoľko teplôt, je lepšie určiť graficky aktivačnú energiu. Za týmto účelom je vyrobený graf LN (k) vs 1/t, ktorý je uvedený nižšie.
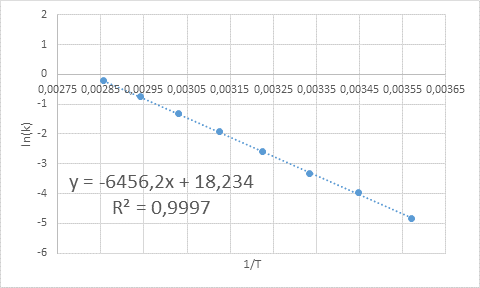 Príklad grafického stanovenia aktivačnej energie
Príklad grafického stanovenia aktivačnej energie Z rovnice čiary zobrazenej v grafe sa získa sklon, ktorý je -6456.2. Pretože sklon (m) sa rovná - edo/R, potom:
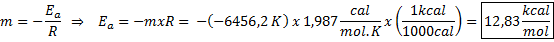
To znamená, že aktivačná energia tejto reakcie je 12,83 kcal/mol.

