Štruktúra disulfidu uhlíka (CS2), vlastnosti, použitie, riziká
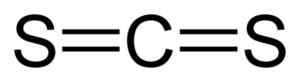
- 940
- 184
- Alan Milota
On disulfid uhlíka Je to zlúčenina tvorená spojením atómu uhlíka (C) a dvoch atómov síry (S). Jeho chemický vzorec je CS2. Je to bezfarebná alebo mierne žltá tekutina s nepríjemným zápachom kvôli nečistotám, ktoré obsahuje (zlúčeniny síry). Keď je jeho vôňa mäkká a sladká, podobná chloroformu alebo éteru.
Prirodzene pochádza z pôsobenia slnečného svetla na organické molekuly nachádzajúce sa v morskej vode. Okrem toho sa vyskytuje v močových vodách a je tiež vylúčený zo sopiek spolu s ďalšími plynmi.
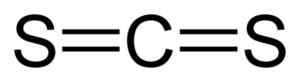 CS uhlíkový disulfid2. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
CS uhlíkový disulfid2. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Uhlíkový disulfid je prchavá tekutina a je tiež veľmi horľavá, takže sa musí držať ďalej od plameňov a iskier alebo zariadení, ktoré ich môžu vyrábať, vrátane elektrických žiaroviek.
Má schopnosť rozpustiť veľké množstvo zlúčenín, materiálov a prvkov, ako je fosfor, síra, selén, živice, lakky atď. Preto považuje za užitočnosť ako rozpúšťadlo.
Je tiež sprostredkovateľom v rôznych priemyselných chemických reakciách, ako je produkcia Rayonu alebo umelé hodváb.
Musí byť manipulovaná opatrne a s ochrannými náradím, pretože je veľmi toxický a nebezpečný.
[TOC]
Štruktúra
Disulfid uhlíka má atóm uhlíka a dva atómy síry na bokoch tohto.
Prepojenia medzi atómom uhlíka a atómami síry sú kovalentné a dvojnásobné, preto sú veľmi silné. Molekula CS2 Má lineárnu a symetrickú štruktúru.
 Lineárna štruktúra disulfidu uhlíka CS2. Čierna = uhlíka, žltá = síra. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons.
Lineárna štruktúra disulfidu uhlíka CS2. Čierna = uhlíka, žltá = síra. Autor: Benjah-Bmm27. Zdroj: Wikimedia Commons. Menovanie
- Disulfid uhlíka
- Bisulfid uhlíka
- Anhydrid ditiokarbonický
Vlastnosti
Fyzický stav
Bezfarebný až žltkastý.
Molekulová hmotnosť
76,15 g/mol
Fúzia alebo solidifikácia
-110,8 ° C
Bod varu
46,0 ° C
Bod vzplanutia
-30 ° C (metóda zatvoreného pohára).
Teplota
90 ° C
Hustota
Kvapalina = 1,26 g/cm3 pri 20 ° C.
Para = 2,67 -násobok vzduchu.
Jeho výpary sú viac ako dvojité ťažké ako vzduch a tekutina je ťažšia ako voda.
Tlak vodnej pary
279 mmHg pri 25 ° C.
Môže vám slúžiť: hypochlorit draselného (KCLO)Toto je vysoký tlak pary.
Rozpustnosť
Veľmi málo rozpustných vo vode: 2,16 g/l A 25 ° C. Rozpustný v chloroforme. Misilné s etanolom, metanolom, éterom, benzénom, chloroformom a tetrachloridom uhlíka.
Chemické vlastnosti
CS2 Pri izbovej teplote sa ľahko odparuje, pretože jeho bod varu je veľmi nízky a jeho tlak pary je veľmi vysoký.
Disulfid uhlíka je mimoriadne horľavý. Jeho výpary sú veľmi ľahko zapálené, dokonca aj s teplotou elektrickej žiarovky. To znamená, že veľmi rýchlo reaguje s kyslíkom:
Cs2 + 3 o2 → CO2 + 2 SO2
Skutočnosť, že máte vysoký tlak pary pri izbovej teplote, robí nebezpečné byť blízko plameňa.
Pri zahrievaní na rozklad sa môže ľahko využiť, emitujúce toxické plyny z oxidov síry. Nad 90 ° C je zapnutá spontánne.
Rozpadne sa, keď je po dlhú dobu skladovaný. Zaútočiť na meď a jej zliatiny. Reaguje tiež s niektorými plastmi, gumami a povlakmi.
Reaguje za určitých podmienok s vodou, tvoriaci karbonyl sulfid, oxid uhlia Co2 a disulfid vodíka h2S:
Cs2 + H2O → OCS + H2Siež
Cs2 + 2 h2O → co2 + 2 h2Siež
S alkoholmi (ROH) v alkalickom médiu Xantáty (RO-CS-NNA):
Cs2 + ROH + NaOH → H2Alebo + ro -c (= s) -sna
Získanie
Uhlíkový disulfid sa komerčne pripravuje reakciou síry s uhlím. Proces sa vykonáva pri teplotách 750-900 ° C.
C + 2 s → CS2
Namiesto uhlia môžete tiež používať metán alebo zemný plyn a použili sa dokonca aj etán, propán a propylén.
Môže sa tiež pripraviť reagovaním na zemný plyn s sulfidom vodíka H2S veľmi vysokou teplotou.
Prítomnosť v prírode
CS2 Je to prírodný produkt prítomný v atmosfére vo veľmi malých množstvách (stopy). Vyskytuje sa fotochemicky v povrchových vodách.
Pôsobenie slnečného svetla na určité zlúčeniny prítomné v morskej vode, ako je cysteín (aminokyselina), vedie k tvorbe disulfidu uhlíka.
 Disulfid uhlíka môže byť vytvorený pôsobením solárnych lúčov na niektoré organické zlúčeniny prítomné v morskej vode. Autor: pexels. Zdroj: Pixabay.
Disulfid uhlíka môže byť vytvorený pôsobením solárnych lúčov na niektoré organické zlúčeniny prítomné v morskej vode. Autor: pexels. Zdroj: Pixabay. Je tiež prirodzene uvoľňovaný počas sopečných erupcií a nachádza sa v malých množstvách nad močiarmi.
Môže vám slúžiť: benzaldehydNormálne sme vystavení dýchaniu vo veľmi malých rozmeroch a je prítomné v niektorých potravinách. Nachádza sa tiež v dyme cigariet.
V prostredí sa rozkladá cez slnečné svetlo. Na zemi sa cez ňu pohybuje. Niektoré pôdne mikroorganizmy sa rozkladajú.
Žiadosti
V chemickom priemysle
Uhlíkový disulfid je dôležitá chemická zlúčenina, ktorá slúži na prípravu iných chemikálií. Môže pôsobiť ako chemický sprostredkovateľ.
Používa sa tiež ako procesné rozpúšťadlo, napríklad na rozpustenie fosforu, síry, selénu, brómu, jódu, tukov, živicí, voskov, lakov a gumov.
Umožňuje výrobu farmaceutických výrobkov a herbicídov.
Vo výrobe Rayón a Celofán
S CS2 Sú pripravené Xantatos, ktoré sú zlúčeniny používané pri výrobe Rayón a celofán.
Aby sa získal umelé hodváb alebo Rayon, je založený na celulóze, ktorá je ošetrená alkáliou a disulfidom uhlíka CS2 a transformuje sa na celulózový xantát, rozpustný v alkali. Toto riešenie je viskózne, a preto sa nazýva „viscosa“.
Viskóza sa vyrába pod tlakom cez veľmi malé otvory vo vnútri kyslého kúpeľa. Tu sa celulóza xantát opäť transformuje na celulózu, ktorá je nerozpustná a vytvárajú sa dlhé a jasné vlákna.
Vlákna alebo vlákna sa môžu točiť, aby poskytli materiál známy ako Rayón.
(1) Celulóza + NaOH → alkali-celulosa
Roh + naoh → rona
(2) Alkali-celulóza + disulfid uhlíka → celulóza xantát
Rona + s = c = s → ro -c (= s) -Sna
(3) Xantát celulózy + kyselina → celulóza (vlákna)
RO -C (= S) -SNA + kyselina → ROH
 Oblečenie vyrobené z Rayonu, vlákniny, ktorého výroba sa podieľa na disulfidu uhlíka. Tobias „Take“ Maier [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons.
Oblečenie vyrobené z Rayonu, vlákniny, ktorého výroba sa podieľa na disulfidu uhlíka. Tobias „Take“ Maier [CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0)]. Zdroj: Wikimedia Commons. Ak je celulóza vyzrážaná prenosom Xantato cez úzky slot, celulóza sa regeneruje vo forme tenkých listov, ktoré tvoria celofán. Toto je zmäknuté glycerolom a používa sa ako ochranný film s objektom.
 Celozfán sa vyrába pomocou disulfidu uhlíka. Autor: Hans Braxmeier. Zdroj: Pixabay.
Celozfán sa vyrába pomocou disulfidu uhlíka. Autor: Hans Braxmeier. Zdroj: Pixabay. Pri výrobe tetrachloridu uhlíka
Disulfid uhlíka reaguje s chlórom CL2 Dodať ccl s tetrachloridom uhlíka4, čo je dôležité rozpúšťadlo, ktoré nie je palivo.
Môže vám slúžiť: chlórbenzén (C6H5Cl)Cs2 + 3 cl2 → CCL4 + Siež2Cl2
V niekoľkých aplikáciách
Uhlíkový disulfid sa podieľa na studenej vulkanizácii gumy.
Xantatos pripravený s CS2 Používajú sa pri minerálnej flotácii.
Staré použitie
CS2 Je to jed pre živé organizmy. Predtým sa použil na zničenie škodcov, ako sú potkany, marmotes a mravce, nalievanie tekutiny v každom uzavretom priestore, v ktorom tieto zvieratá žili (Burrows a Hormigueros)).
Keď sa na tento účel použili husté toxické pary, ukončili každý živý organizmus, ktorý bol v uzavretom priestore.
Používala sa tiež ako antihelmintika pre zvieratá a na odstránenie lariev z moscardónov z žalúdka koní.
V poľnohospodárstve sa používalo ako insekticíd a nematicid, na fumimáciu pôdy, fumigáciu škôlok, stodolov, síl a obilnín. Železničné autá, lode a člny boli tiež fumigované.
 Farmár v roku 1904 fumigáciou pôdy disulfidom uhlíka na boj proti moru hroznových rastlín. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.GNU.Org/licencie/staré licenky/FDL-1.2.html)]. Zdroj: Wikimedia Commons.
Farmár v roku 1904 fumigáciou pôdy disulfidom uhlíka na boj proti moru hroznových rastlín. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.GNU.Org/licencie/staré licenky/FDL-1.2.html)]. Zdroj: Wikimedia Commons. Všetky tieto použitia boli zakázané kvôli vysokej horľavosti a toxicite CS2.
Riziká
CS2 Je to veľmi horľavé. Mnohé z vašich reakcií môžu spôsobiť oheň alebo výbuch. Zmesi ich výparov so vzduchom sú výbušné. Pri zápale spôsobuje dráždivé alebo toxické plyny.
Uhlíkový disulfid pre odtoky by sa nemal nalievať, pretože v skúmavkách je zmes CS2 a vzduch, ktorý môže spôsobiť výbuch, ak je náhodou osvetlený.
Jeho výpary spontánne oheň v kontakte s iskrami alebo horúcimi povrchmi.
Disulfid uhlíka vážne dráždi oči, pokožku a sliznice.
Ak je centrálny nervový systém vdychovaný alebo vážne požitý, kardiovaskulárny systém, oči, obličky a pečeň. Môže sa tiež absorbovať cez pokožku, čo spôsobuje poškodenie.
Odkazy
- Alebo.Siež. Lekárska knižnica. (2020). Disulfidový uhlík. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Mopper, k. A Kieber, D.J. (2002). Photochémia a cyklistika uhlíka, síry, dusíka a posferu. V biogeochémii morských rozpustených organických látok. Zotavené z vedeckých pracovníkov.com.
- Meyer, b. (1977). Priemyselné využitie síry a jej kompundov. Disulfidový uhlík. V síre, energiu a závisti. Zotavené z vedeckých pracovníkov.com.
- Pohanish, r.P. (2012). C. Disulfidový uhlík. V Sittigovej príručke toxických a nebezpečných chemikálií a karcinogénov (šieste vydanie). Zotavené z vedeckých pracovníkov.com.
- Morrison, r.Tón. a Boyd, r.N. (2002). Organická chémia. 6. vydanie. Hara.
- Windholz, m. a kol. (redaktori) (1983). Index Merck. Enyklopedia chemikálií, liekov a biologických. Desiate vydanie. Merck & Co., Inc.
- « 95 najlepších fráz katolíckych svätých
- +105 Katolícke frázy o viere, reflexii, modlitbe a nádeji »

