Denaturácia proteínu Čo je to, faktory, dôsledky
- 1233
- 30
- Václav Višňovský
Čo je denaturácia proteínov?
Ten denaturácia proteínu Skladá sa zo straty trojrozmernej štruktúry v dôsledku rôznych faktorov prostredia, ako je teplota, pH alebo určité chemické látky. Strata štruktúry má za následok stratu biologickej funkcie spojenej s týmto proteínom, či už okrem iného enzymatický, štrukturálny transportér.
Štruktúra proteínu je vysoko citlivá na zmeny. Destabilizácia jediného esenciálneho vodíkového mosta môže denaturalizovať proteín. Rovnakým spôsobom existujú interakcie, ktoré nie sú prísne nevyhnutné na splnenie proteínovej funkcie a v prípade destabilizácie nemá žiadny vplyv na operáciu.
Proteín
Aby sme pochopili procesy denaturácie proteínu, musíme vedieť, ako sú organizované proteíny. Majú primárnu, sekundárnu, terciárnu a kvartérnu štruktúru.
Primárna štruktúra
Je to aminokyselinová sekvencia, ktorá tvorí tento proteín. Aminokyseliny sú základnými blokmi, ktoré tvoria tieto biomolekuly a existuje 20 rôznych typov, z ktorých každý má konkrétne fyzikálne a chemické vlastnosti. Spájajú sa pomocou peptidového spojenia.
Sekundárna štruktúra
V tejto štruktúre sa tento lineárny reťazec aminokyselín začne skladať vodíkovými mostmi. Existujú dve základné sekundárne štruktúry: α vrtule, špirálová tvare; a skladací list β, keď sú dva lineárne reťazce zarovnané paralelne.
Terciárna štruktúra
Zahŕňa ďalšie typy síl, ktoré vedú k špecifickému skladaniu trojrozmernej formy.
Rafy R aminokyselinových zvyškov, ktoré tvoria štruktúru proteínu, môžu tvoriť disulfidové mostíky a hydrofóbne časti proteínov sú zoskupené vo vnútri, zatiaľ čo hydrofilny čelia vode k vode. Sily Van der Waals pôsobia ako stabilizátor opísaných interakcií.
Môže vám slúžiť: izoleucín: Charakteristiky, funkcie, biosyntéza, jedloKvartérna štruktúra
Skladá sa z agregátov proteínových jednotiek.
Keď je proteín denaturovaný, stráca kvartérnu, terciárnu a sekundárnu štruktúru, zatiaľ čo primárny zostáva nedotknutý. Proteíny, ktoré sú bohaté na disulfidové spojenia (terciárna štruktúra), poskytujú väčšiu denaturačnú odolnosť.
Faktory, ktoré spôsobujú denaturáciu
Akýkoľvek faktor, ktorý destabilizuje nekovalentné väzby zodpovedné za udržiavanie natívnej štruktúry proteínu, môže produkovať jeho denaturáciu. Medzi najdôležitejšie môžeme spomenúť:
pH
Pri veľmi extrémnych hodnotách pH, či už kyslých alebo základných prostriedkov, proteín môže stratiť svoju trojrozmernú konfiguráciu. Prebytok hones h+ a oh- v strede destabilizuje proteínové interakcie.
Táto zmena vzoru iónov spôsobuje denaturáciu. Denaturácia pH môže byť v niektorých prípadoch reverzibilná a v iných nezvratných.
Teplota
K tepelnej denaturácii dochádza zvýšením teploty. V organizmoch, ktoré žijú v priemerných podmienkach prostredia, proteíny začínajú destabilizovať pri teplotách vyšších ako 40 ° C. Je zrejmé, že proteíny termofilného organizmu môžu podporovať tieto teplotné rozsahy.
Zvýšenie teploty sa prekladá do zvýšenia molekulárnych pohybov, ktoré ovplyvňujú vodíkové mosty a iné nekovalentné väzby, čo vedie k strate terciárnej štruktúry.
Tieto zvýšenie teploty vedie k reakčnej rýchlosti, ak hovoríme o enzýmoch.
Chemické látky
Polárne látky - napríklad močovina - vo vysokých koncentráciách ovplyvňujú vodíkové mosty. Podobne, nepolárne látky môžu mať podobné následky.
Detergenty môžu tiež destabilizovať proteínovú štruktúru; Nejde však o agresívny proces a sú väčšinou reverzibilné.
Môže vám slúžiť: Nemecký šváb: Charakteristiky, reprodukcia, jedloRedukcia agentov
P-merkaptoetanol (Hoch2ch2sh) je chemické činidlo s častým používaním v laboratóriu na denaturalizáciu proteínov. Je zodpovedný za zníženie disulfidových mostov medzi odpadom z aminokyselín. Môže destabilizovať terciárnu alebo kvartérnu štruktúru proteínu.
Ďalším redukčným činidlom s podobnými funkciami je Ditiotreitol (DTT). Okrem toho ďalšie faktory, ktoré prispievajú k strate natívnej štruktúry proteínov, sú ťažké kovy vo vysokých koncentráciách a ultrafialové žiarenie.
Následky denaturácia proteínu
Keď dôjde k denaturalizácii, proteín stráca svoju funkciu. Proteíny pracujú optimálne, keď sú vo svojom pôvodnom stave.
Strata funkcie nie je vždy spojená s procesom denaturácie. Malá zmena v proteínovej štruktúre môže viesť k strate funkcie bez destabilizácie celej trojrozmernej štruktúry.
Proces môže alebo nemusí byť nezvratný. V laboratóriu, ak sú podmienky zvrátené, že sa proteín vráti k svojej počiatočnej konfigurácii.
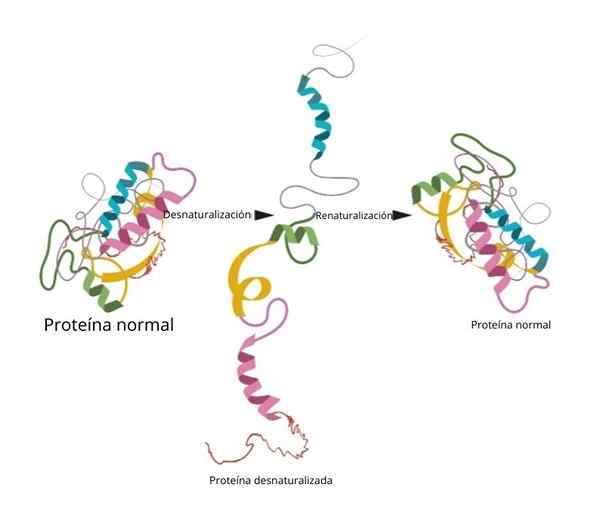
Renaturalizácia
Jeden z najslávnejších a najzreteľnejších experimentov o renaturalizácii bol preukázaný v ribonukleáze.
Keď vedci pridali denaturačné činidlá, ako je močovina alebo β-merkaptanol, proteín bol denaturovaný. Ak boli tieto látky odstránené, proteín sa vrátil na svoju natívnu konformáciu a mohol by vykonávať svoju funkciu so 100 % účinnosťou.
Jedným z najdôležitejších záverov tohto výskumu bolo experimentálne preukázať, že trojrozmerná konformácia proteínu je daná jeho primárnou štruktúrou.
V niektorých prípadoch je proces denaturalizácie úplne nezvratný. Napríklad, keď varíme vajíčko, aplikujeme teplo v proteínoch (hlavný je albumín), ktorý ho tvoria, Clear má pevný a belavý vzhľad. Intuitívne môže vyvodiť záver, že hoci ho ochladíme, nevráti sa do svojej pôvodnej podoby.
Môže vám slúžiť: vagenéza: fázy, charakteristiky zvierat a rastlínVo väčšine prípadov je proces denaturalizácie sprevádzaný stratou rozpustnosti. Viskozita, rýchlosť difúzie sa tiež zníži a ľahšie kryštalizuje.
Proteíny
Chaperonas alebo chaperonínové proteíny sú zodpovedné za prevenciu denaturácie iných proteínov. Tiež potláčajú určité interakcie, ktoré nie sú medzi proteínmi primerané, aby sa zabezpečilo správne ich skladanie.
Keď sa stredná teplota zvyšuje, tieto proteíny zvyšujú ich koncentráciu a pôsobia tým, že zabránia denaturácii iných proteínov. Z tohto dôvodu sa nazývajú aj „proteíny tepelného šoku“ alebo HSP pre svoju skratku v angličtine (Proteíny tepelného šoku).
Chaperoníny sú analogické s klietkou alebo hlavňou, ktorá chráni vo vnútri proteín, ktorý je predmetom záujmu.
Tieto proteíny, ktoré reagujú na situácie bunkového stresu, boli hlásené v rôznych skupinách živých organizmov a sú vysoko zachované. Existujú rôzne druhy chaperonínov a sú klasifikované podľa ich molekulovej hmotnosti.

