Halogenované deriváty

- 2092
- 98
- Tomáš Mydlo
Vysvetľujeme, čo sú halogénované deriváty, ich vlastnosti, použitia/aplikácie a uvádzame niekoľko príkladov
Čo sú halogénované deriváty?
Ten halogenované deriváty Všetky sú to zlúčeniny, ktoré majú atóm halogénu; To znamená, že ktorýkoľvek z prvkov skupiny 17 (F, Cl, Br, I). Tieto prvky sa líšia od ostatných, pretože sú viac elektronegatívni a tvoria rozmanitosť anorganických a organických halogenidov.
Dolný obrázok halogénov je zobrazený na spodnom obrázku. Zhora nadol: fluorid (f2), Chlór (CL2), Bromo (br2) a jód (i2). Každá z nich má schopnosť reagovať s drvivou väčšinou prvkov, a to aj medzi kongenérmi tej istej skupiny (interhalogény).

Halogénované deriváty majú teda vzorec MX, ak ide o kovový halo haluro, rx, ak je alkyl a arx, ak je aromatický. Posledné dva sa nachádzajú v kategórii Organic Haluros. Stabilita týchto zlúčenín vyžaduje „výhodu“ energie pred pôvodnou molekulou sódy.
Spravidla fluorid tvorí halogénnu stabilnejšie ako jód. Dôvod je z dôvodu rozdielov medzi ich atómovými rádiami (fialové gule sú objemnejšie ako tie žlté).
Zvýšením atómového polomeru je prekrývanie orbitálov medzi halogénom a druhým atómom horšie, a preto je spojenie slabšie.
Menovanie
Spôsob, ako správne pomenovať tieto zlúčeniny, závisí od toho, či sú anorganické alebo organické.
Anorganický
Kovové halogenidy pozostávajú z väzby, iónovej alebo kovalentnej, medzi halogénom X a M kovom (zo skupín 1 a 2, prechodných kovov, ťažkých kovov atď.).
V týchto zlúčeninách majú všetky halogény oxidačný stav -1. Pretože? Pretože jeho konfigurácie Valencia sú NS2Np5.
Preto musia vyhrať iba jeden elektrón, aby dokončili oktet Valencie, zatiaľ čo kovy oxidujú, čo im dáva elektróny, ktoré majú.
Môže vám slúžiť: Presná rovnováha: Charakteristiky, funkcie, časti, použitiaFluorid teda zostáva ako f-, fluorid; Cl-, chlorid; Br-, bromid; a ja-, Posledný. MF by sa pomenoval: fluorid (názov kovu) (n), keď je NALECICA DEL Metal iba vtedy, keď má viac ako jeden. V prípade skupín skupín 1 a 2 nie je potrebné pomenovať Valencia.
Príklady
- NAF: fluorid sodný.
- Kacl2: chlorid vápenatý.
- AGBR: strieborný bromid.
- ZNI2: Zinok yoduro.
- CUCL: chlorid meďnatého (I).
- Cucl2: chlorid meďnatého (II).
- Tekl4: Chlorid titánu (IV) alebo titano tetrachlorid.
Avšak vodíkové a nemetálne prvky - dokonca aj tie isté halogény - môžu tiež tvoriť haluros. V týchto prípadoch nie je na konci vymenovaný Valencia z kovu No Metal:
- Pcl5: fosfor pentachlorid.
- Bf3: Boro trifluoruro.
- Ali3: Hliníkové triyoduro.
- HBR: Bromid vodíka.
- Či7: jódový heptofluorid.
Organický
Bez ohľadu na to, či RX alebo ARX, je halogén kovalentne spojený s atómom uhlíka. V týchto prípadoch sa halogény spomínajú podľa ich mien a zvyšok nomenklatúry závisí od molekulárnej štruktúry R alebo AR.
Pre najjednoduchšiu organickú molekulu, metán (CHO4), Nasledujúce deriváty sa získajú nahradením H za CL:
- Chvály3CL: Chloromethane.
- Chvály2Cl2: dichlórmetán.
- CHCL3: Tricylorometán (chloroform).
- Ccl4: Tetrachlórmetán (chlorid uhlíka (IV) alebo tetrachlorid uhlíka).
Tu R pozostáva z jedného atómu uhlíka. Potom pre iné alifatické reťazce (lineárne alebo vetvy) sa počíta počet uhlíkov, z ktorých je spojený s halogénom:
Chvály3Chvály2Chvály2F: 1-fluorpropano.
Predchádzajúcim príkladom bol príklad primárneho alquilického halogenidu. V prípade, že je reťazec rozvetvený, je zvolený najdlhší obsahujúci halogén a začne sa počítať, pričom toto je možné číslo:
Môže vám slúžiť: Aké sú fyzické vlastnosti hmoty?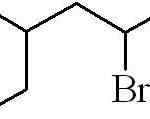
3-metyl-5-brómxan
Rovnakým spôsobom sa vyskytuje pre ostatných substituentov. Tiež pre aromatické halogenidy sa vymenuje halogén a potom zvyšok štruktúry:

Vynikajúci obrázok zobrazuje zlúčeninu nazývanú bromobenzén, ktorá zvýrazňuje atóm brómu v hnedej farbe.
Vlastnosti halogénovaných derivátov
Anorganické halogenidy
Anorganické halogenidy sú iónové alebo molekulárne tuhé látky, hoci prvé sú hojnejšie. V závislosti od interakcií a iónových rádií MX to bude rozpustné vo vode alebo iných menej polárnych rozpúšťadlách.
Nemetalické halogenidy (napríklad boro) sú zvyčajne Lewis kyseliny, čo znamená, že akceptujú elektróny za vzniku komplexov. Na druhej strane, halogenidy (alebo halogenuros) vodíka rozpusteného vo vode produkujú to, čo sa nazýva hydracídy.
Jeho topiace sa body, varenie alebo sublimácia padajú na elektrostatické alebo kovalentné interakcie medzi kovom alebo ne -metal s halogénom.
Podobne aj iónové rádiá hrajú v týchto vlastnostiach dôležitú úlohu. Napríklad, ak m+ a x- Majú podobné veľkosti, ich kryštály budú stabilnejšie.
Organické halogenidy
Sú polárne. Pretože? Pretože rozdiel v elektronegativite medzi C a halogénom vytvára v molekule trvalý polárny moment. To tiež klesá, keď zostupuje skupina 17, od odkazu C-F s C-I.
Bez ohľadu na molekulárnu štruktúru R alebo AR, rastúce čísla halogénu priamo ovplyvňujú body varu, pretože zvyšujú molárnu hmotnosť a intermolekulárne interakcie (RC-X-X-CR). Väčšina z nich je nemiešateľná s vodou, ale môže sa rozpustiť v organických rozpúšťadlách.
Použitie halogénovaných derivátov
Použitie halogénovaných derivátov by si mohlo rezervovať svoj vlastný text. Molekulárne „spoločníci“ halogénov sú kľúčovým faktorom, keďže ich vlastnosti a reaktivity definujú použitie derivátu.
Môže vám slúžiť: síran draselný (K2SO4): Štruktúra, vlastnosti, použitie, syntézaMedzi veľkú rozmanitosť možných použití teda vyniká toto:
- Molekulárne halogény sa používajú na vytváranie halogénových žiaroviek, kde sa dostanete do kontaktu s žiarovkovým volfrámovým vláknom. Účelom tejto zmesi je reagovať halogén X s odparovaným volfrámom. Týmto spôsobom sa jeho ukladaniu vyhýba na povrchu žiarovky, čím sa zaručuje viac životného času.
- Soli fluór sa používajú pri fluorizácii zubných vôd a pastov.
- Hypochlority sodíka a vápnika sú dva aktívne činidlá v komerčných bieliacich roztokoch (chlór).
- Aj keď zhoršujú ozónovú vrstvu, chlórofluórnosti (CFC) sa používajú v aerosóloch a chladiacich systémoch.
- Vinylchlorid (CHO2= Chcl) je monomér chloridu polyvinyl polyméru (PVC). Na druhej strane teflón, ktorý sa používa ako materiál, ktorý nie je v porovnaní, sa skladá z polymérnych reťazcov tetrafluoretylénu (f (f2C = cf2).
- Používajú sa v analytickej chémii a organickej syntéze na rôzne účely; Medzi nimi syntéza liekov.
Ďalšie príklady

Vynikajúci obraz ilustruje hormón štítnej žľazy, ktorý je zodpovedný za produkciu tepla, ako aj za zvýšenie všeobecného metabolizmu v tele. Táto zlúčenina je príkladom halogénovaného derivátu prítomného v ľudskom tele.
Medzi ostatnými halogénovanými zlúčeninami sú uvedené nasledujúce:
- Diclorodifenilrlorootan (DDT), účinný insekticíd, ale s vážnymi vplyvmi na životné prostredie.
- Cínový chlorid (SNNCL2), používané ako redukčné činidlo.
- Chlóretán alebo 1-chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán (chlóretán3Chvály2Cl), lokálne anestetikum, ktoré pôsobí rýchlo ochladzujúcim pokožku.
- Dichlóretylén (CLCH = CCLH) a tetrachloretylén (CL2C = ccl2), používané ako rozpúšťadlá v priemysle suchého čistenia.
- « Silikónová karbidová chemická štruktúra, vlastnosti a použitia
- 80 fráz pre prvú lásku, ktorá nikdy nezabudne »

