Chrome (CR)

- 3210
- 613
- Alfréd Blaho
 Chrome je veľmi reaktívny kov. Wikimedia Commons
Chrome je veľmi reaktívny kov. Wikimedia Commons Čo je chróm?
On chróm (CR) je chemický prvok skupiny 6 (VIB) periodickej tabuľky. Ročne sa tony tohto kovu vyrábajú extrakciou chromitu alebo minerálu horečnatého (FECR2Ani4, Mgcr2Ani4), ktoré sa znižujú uhlím na získanie kovu. Je veľmi reaktívny a iba vo veľmi redukčných podmienkach je vo svojej čistej podobe.
Jeho minerály a oxidy, ako aj malá kovová časť medi, spôsobujú, že tento prvok zaberá číslo 22 najpoužívanejších z zemskej kôry.
Chrómová chémia je veľmi rozmanitá, pretože môže tvoriť prepojenia s takmer celú celú periodickú tabuľku. Každá z jeho zlúčenín vykazuje farby, ktoré závisia od oxidačného čísla, ako aj od druhov, ktoré s ním interagujú.
Tiež formujte odkazy na uhlí.
Chrómové charakteristiky a vlastnosti
Chróm je strieborný kov vo svojej čistej forme, s atómovým číslom 24 a molekulovou hmotnosťou približne 52 g/mol (52CR, jeho najstabilnejší izotop).
Vzhľadom na svoje silné kovové spojenia predstavuje body fúzie (1907 ° C) a varenie (2671 ° C) vysoké. Jeho kryštalická štruktúra z nej robí veľmi hustý kov (7.19 g/ml).
Nereaguje s vodou, aby sa vytvoril hydroxidy, ale s kyselinami. Oxiduje sa kyslíkom vzduchu, ktorý všeobecne produkuje chrómový oxid, ktorý je široko používaný zelený pigment.
Tieto vrstvy oxidu vytvárajú to, čo je známe ako Pasivácia, Ochrana kovu pred následnými koróziami, pretože kyslík nemôže preniknúť do kovového sínusu.
Jeho elektronická konfigurácia je [AR] 4S13D5, So všetkými chýbajúcimi elektrónmi, a preto vykazuje paramagnetické vlastnosti. Pri párení elektronických točení sa však môže vyskytnúť, ak je kov vystavený nízkym teplotám, pričom získava ďalšie vlastnosti, ako je napríklad antiferomagnetizmus.
Môže vám slúžiť: refraktérne materiályChemická chrómová štruktúra
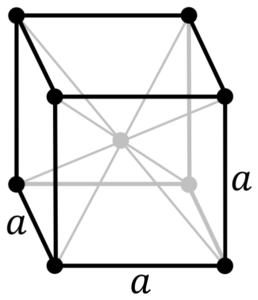 Chrómová kovová štruktúra. Zdroj: Pôvodné PNGS od Daniela Mayera, Drbob, Wikimedia Commons
Chrómová kovová štruktúra. Zdroj: Pôvodné PNGS od Daniela Mayera, Drbob, Wikimedia Commons Aká je štruktúra chrómového kovu? Vo svojej čistej forme chróm prijíma kubickú kryštalickú štruktúru sústredenú na tele (CC alebo BCC). To znamená, že atóm chrómov sa nachádza v strede kocky, ktorej okraje sú obsadené inými chrómami (ako v vynikajúcom obrázku).
Táto štruktúra je zodpovedná za chróm, ktorý má vysoké body topenia a varu, ako aj veľkú tvrdosť. Atómy medi prekrývajú svoje orbitály S a D, aby vytvorili jazdecké pásma podľa teórie kapely.
Obidve pásma sú teda plné na polovicu, pretože ich elektronická konfigurácia je [AR] 4S13D5, A ako orbitálna s, môžu umiestniť dva elektróny a orbitály po desiatich. Potom iba polovica pásov vytvorených ich prekrývajúcimi sa obsadí elektrónmi.
S týmito dvoma perspektívami -kryštalická štruktúra a kovové spojenie -z mnohých fyzikálnych vlastností tohto kovu možno vysvetliť teoreticky. Avšak ani vysvetľuje, prečo Chrome môže mať niekoľko stavov alebo oxidačných čísel.
Z tohto dôvodu hlboké pochopenie stability atómu vzhľadom na elektronické točenie.
Chrómové oxidačné číslo
Pretože chrómová elektronická konfigurácia je [AR] 4S13D5 Môžete vyhrať až jeden alebo dva elektróny (cr1- a cr2-) alebo ich strata, aby ste získali rôzne oxidačné čísla.
Ak teda chróm stratí elektrón, bol by ako [ar] 4s03D5; Ak stratíte tri, [ar] 4s03D3; A ak ich stratíte, [AR] alebo čo je rovnaké, bolo by to izolektronické pre Argon.
Môže vám slúžiť: bod varu: koncept, výpočet a príkladyChromium nestráca ani nezískava elektróny v dôsledku obyčajného rozmaru: musí existovať druh, ktorý ich robí alebo akceptuje, aby prešli z jedného oxidačného čísla na druhé.
Chróm má nasledujúce oxidačné čísla: -2, -1, 0, +1, +2, +3, +4, +5 a +6. Z nich +3, cr3+, Je to najstabilnejší, a preto prevláda zo všetkých; nasledované +6, cr6+.
Chrómové použitie
Ako farbivo alebo pigment
Chróm má širokú škálu aplikácií, od farbiva pre rôzne typy textílií, po ochrancu, ktorý skrášľuje kusy kovov, v tom, čo je známe ako chromed, ktoré sa dajú robiť čistým kovom alebo s CR zlúčeninami (III) alebo CR (Vi).
Cromic Fluoruro (CRF3), napríklad sa používa ako farbivo pre vlnené tkaniny; Cromický sulfát (Cr2(SW4)3( a chrómový oxid (cr2Ani3) Tiež nájdite použitie, kde je potrebná atraktívna zelená farba.
Preto môže byť akýkoľvek chrómový minerál s intenzívnymi farbami určený na farbenie štruktúry, ale potom skutočnosť, či sú tieto zlúčeniny nebezpečné alebo nie pre životné prostredie alebo pre zdravie jednotlivcov.
V skutočnosti sa jeho jedovaté vlastnosti používajú na ochranu drevených a iných útočných povrchov hmyzu.
V chrómovanej alebo metalurgii
Podobne sa pridávajú malé množstvá chrómu do ocele na jeho posilnenie tvárou v tvár oxidácii a na zlepšenie jeho jasu. Je to preto, že je schopný vytvoriť sivé karbidy (cr3C2) Veľmi odolný pri reagovaní s kyslíkom vzduchu.
Môže vám slúžiť: Hydroxid vápenatý (Ca (OH) 2): Štruktúra, vlastnosti, získanie, použitiaPretože Chrome môže vyleštiť až do jasných povrchov, Chrome potom prezentuje strieborné vzory a farby ako lacnejšiu alternatívu na tieto účely.
Výživový
Určitá debata, ak sa chróm možno považovať za základný prvok, to znamená nevyhnutný v dennej diéte. Je prítomný v niektorých potravinách vo veľmi malých koncentráciách, ako sú zelené listy a paradajky.
Existujú tiež proteínové doplnky, ktoré regulujú inzulínovú aktivitu a uprednostňujú rast svalov, ako je to v prípade chrómovej polynicinatato.
Kde je chróm?
Chróm sa nachádza vo veľkom množstve minerálov a drahokamov, ako sú rubíny a smaragdy. Hlavným minerálom, z ktorého sa chróm extrahuje, je chromit (MCR2Ani4), Kde M môže byť akýkoľvek iný kov, s ktorým je spojený oxid chróm. Tieto bane oplývajú v Južnej Afrike, v Indii, Turecku, Fínsku, Brazílii a ďalších krajinách.
Každý zdroj má jednu alebo viac variantov chromitu. Týmto spôsobom, pre každú M (Faith, Mg, Mn, Zn atď.) Vzniká iná chrómová minerál.
Na extrahovanie kovu je potrebné. To sa deje s uhlíkom alebo hliníkom:
Fecr2Ani4 + 4C => Fe + 2Cr + 4Co
Podobne sa nachádza chromita (PBCRO4).
Zvyčajne v akomkoľvek mineráli, kde ión Cr3+ môže vymeniť al3+, Obaja s mierne podobnými iónovými rádiámi predstavuje nečistotu, ktorá vedie k ďalšiemu prírodnému zdroju tohto úžasného, ale škodlivého kovu.
Odkazy
- Tenebaum e. Chróm. Zobraté z: chémie.Pomona.Edu
- Chémia librettexts. Chémia chrómu. Prevzaté z: chem.Librettexts.orgán
- Chróm. Zobraté z: ChemistryExplaed.com

