Chemická zlúčenina
- 1394
- 396
- MUDr. Miloslav Habšuda
Vysvetlíme, z ktorých chemických zlúčenín pozostávajú z typov, ktoré existujú, rozdiely s chemickými prvkami a uvádzajú niekoľko príkladov.
 Chemické zlúčeniny sú všetky látkou, ktorá má atómy dvoch rôznych chemických prvkov
Chemické zlúčeniny sú všetky látkou, ktorá má atómy dvoch rôznych chemických prvkov Čo je chemická zlúčenina?
A chemická zlúčenina Je to látka tvorená spojením dvoch alebo viacerých atómov rôznych chemických prvkov. Chemické zlúčeniny zostávajú zjednotené vďaka chemickým väzbám, ktoré súvisia s elektrónmi prepojených atómov; to znamená, že v chemickej zlúčenine (najvzdialenejšie) elektróny atómov zasahujú do tvorby spojení.
Zložky chemických zlúčenín (chemické prvky) nemôžu byť navzájom oddelené fyzikálnymi metódami, ako napríklad: destilácia, odstredivka, filtrácia atď., na jeho dosiahnutie vyžaduje chemické metódy.
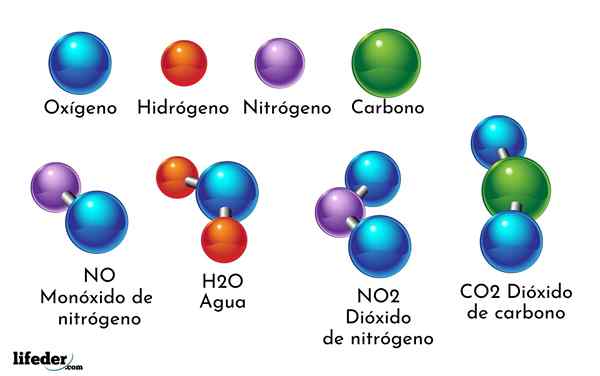
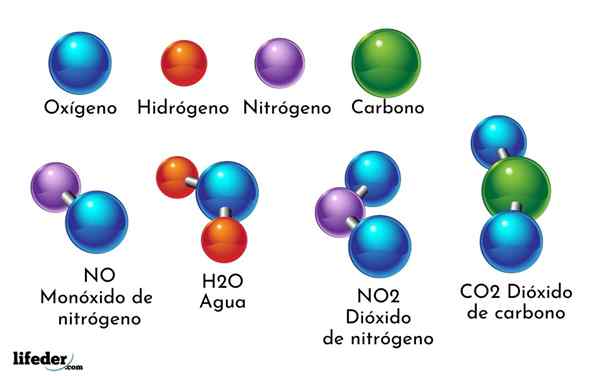
Príkladom chemickej zlúčeniny je voda. Tvorí sa iba dvoma atómami dvoch rôznych chemických prvkov: kyslík a vodík, ktorý má chemický vzorec h2Ani. Preto sa dve h viažu s jedným alebo formou H2Ani.
Chemický prvok, na rozdiel od chemických zlúčenín, je najjednoduchší a najzákladnejší spôsob, akým predstavuje hmotu. Je prezentovaný ako jedinečný typ atómu, ktorý sa nedá rozdeliť na jednoduchšie látky chemickými reakciami.
Typy chemických zlúčenín
Chemické zlúčeniny možno klasifikovať hlavne podľa dvoch kritérií:
- Podľa typu väzby, ktorá spája chemické prvky prítomné v chemickej zlúčenine.
- Podľa zloženia a štruktúry chemickej zlúčeniny.
Podľa typu odkazu
V závislosti od typu prepojenia môžu byť chemické zlúčeniny:
- Molekuly. Sú to chemické zlúčeniny tvorené dvoma alebo viacerými typmi rôznych chemických prvkov, ktoré sú spojené kovalentnou väzbou. Tento odkaz sa vyznačuje zdieľaním jedného alebo viacerých párov externých elektrónov alebo Valencia medzi dvoma atómami.
- Ión. Elektricky naložené chemické zlúčeniny sa nazývajú iónové chemické zlúčeniny a ich ióny sú spojené podľa iónový odkaz. Táto väzba sa vyskytuje pri spájaní chemického prvku kovového typu s net -kovovým chemickým prvkom.
- Intermetalické zlúčeniny. Je to typ zliatiny kovu, ktorý predstavuje pevný materiál, ktorý je medzi dvoma alebo viacerými kovovými chemickými prvkami, aby ich udržal pohromade.
- Koordinácia. Sú tvorené centrálnym kovovým prvkom, nazývaným koordinačné centrum a ktoré obklopujú súbor zjednotených molekúl alebo iónov známych ako ligandy. Napríklad hemoglobín je proteín, ktorý sa nachádza v červených krvinkách a ktorý transportuje kyslík v krvi. Hemoglobín má koordinačnú zlúčeninu nazývanú grupo hemo. V strede hemo je atóm železa, ktorý zasahuje do transportu kyslíka cez hemoglobín.
Podľa kompozície a štruktúry
Podľa tohto kritéria sú chemické zlúčeniny klasifikované ako organické a anorganické.
- Organické zlúčeniny. Sú to zlúčeniny, ktorých hlavným chemickým prvkom je uhlík, ktorý obvykle tvorí spojenie s atómami toho istého uhlíka a vodíka. Sú však tiež prítomné, aj keď v menšej miere, kyslík, dusík, síra, bór, fosfor atď. Organické zlúčeniny môžu byť:
- Alifatický. Molekuly alifatických zlúčenín môžu mať lineárne alebo cyklické formy, to znamená v uzavretých tvaroch, ako sú trojuholníky, štvorce, pentagóny atď. Môžu mať uhlíkové väzby troch typov: jednoduché (c-c), dvojité (c = c) alebo trojnásobok (C≡C).
- Aromatický. Sú to cyklické zlúčeniny, ktoré striedavo predstavujú jednoduché väzby uhlíka a dvojitých uhlíkových uhlíkových väzieb.
- Heterocyklický. Sú to zlúčeniny, ktoré majú cyklickú štruktúru, ktorá môže prezentovať náhradu atómu uhlíka iným chemickým prvkom (o, s, n atď.).
- Organometalický. Sú to organické zlúčeniny, ktoré sa môžu vyskytnúť v ich zložených kovových prvkoch.
- Polyméry. Sú to veľké molekuly (makromolekuly), ktoré sú tvorené malými a identickými jednotkami, ktoré sa opakujú v celom polyméri a ktoré sa nazývajú monomérie.
- Anorganické zlúčeniny. Anorganické zlúčeniny, na rozdiel od organických, nemajú uhlík ako centrálny chemický prvok, ale skôr zasahujú do ich zloženia väčšinu známych chemických prvkov. Anorganické zlúčeniny môžu byť:
- Základné oxidy. Sú tvorené reakciou kovového chemického prvku, ako je sodík, vápnik, železo, meď atď., S kyslíkom. Napríklad oxid sodný (NAO) je základný oxid. Nazývajú sa základné oxidy, pretože viedli k vzniku základní alebo hydroxidov.
- Oxidy kyselín. Pochádzajú z reakcie nemetalického chemického prvku, ako je chlór, fluór, síra, bróm atď., S kyslíkom. Napríklad oxid bróm (BR2Ani5) Je to oxid kyseliny. Nazývajú sa oxidy kyselín, pretože vedú k kyselinám.
- Hydrors. Vo svojom chemickom zložení sa vyskytujú prítomnosť vodíka. Existujú dva typy: kovové hydros a nemetalické hydrory.
- Kov. Tvoria sa reakciou vodíka s oxidačným stavom -1 s kovom. Tieto chemické zlúčeniny sú jediné, v ktorých je vodík prítomný s oxidačným stavom -1. Napríklad CAH2 Je to hydrid vápenatý.
- Nie kovový. Tvoria sa reakciou vodíka s oxidačným stavom + 1 s nemetalickým prvkom s jeho nižším oxidačným stavom. Hydrid chlóru (HCl) je plyn, ktorý sa rozpustí kyselina chlorovodíková vo vode.
- Kyseliny. Sú to anorganické chemické zlúčeniny, aj keď existujú organické kyseliny, ktoré majú pH menej ako 7 a otáčajú sa na farbu červeného papiera na červenú. Môžu byť klasifikované na hydracycidy a oxacidy.
- Hydracia. Pochádzajú z reakcie vodíka s net -kovou za vzniku hydridu, ktorý sa rozpúšťa vo vode, pôvodne z kyseliny; Napríklad kyselina iahydrová (HI).
- Oxcacidy. Vychádza z reakcie oxidu nemetalického chemického prvku s vodou. Napríklad reakcia oxidu sulfurského (SO3) S vodou produkuje kyselinu sírovú (h2SW4).
- Choď von. Sú to chemické zlúčeniny, ktoré pochádzajú z interakcie kyslých a základných zlúčenín. Vo svojom zložení môže byť toľko kovových prvkov ako nemetalické. Soli sú klasifikované ako:
- Neutrálne soli. Pochádzajú z reakcie neutralizácie medzi kyselinou a bázou s tvorbou soli a vody. Napríklad reakcia hydroxidu sodného (NaOH) s kyselinou chlorovodíkovou (HCL) produkuje chlorid sodný (NaCl), soľ a vodu. Nazývajú sa neutrálne, pretože nevytvárajú variáciu pH.
- Kyslé soli. Vytvárajú sa reakciou kovového hydroxidu s Valencia +1, s kyselinou s niekoľkými hydrogénmi. Reakcia hydroxidu lítium (LIOH) s kyselinou karbónovou (H2Co3), produkuje nahradenie iba jedného vodíka lítiom, ktoré spôsobuje hydrogenuhličitan lítia (lihco3), Kyslá soľ a voda.
- Základné soli. Vyrábajú sa reakciou bázy, ktorá má viac ako jednu skupinu OH s hydracovou kyselinou, napríklad kyselinu chlorovodíkovú. Pri reagovaní kyseliny s hydroxidom vápenatého, CA (OH)2, Atóm chlóru nahrádza hydroxylovú skupinu (OH). Tým sa produkuje hydroxychlorid vápenatého (Cuckloh), základná soľ a voda.
Rozdiely medzi chemickými zlúčeninami a chemickými prvkami
 Na chemické prvky a chemické zlúčeniny. Chemické zlúčeniny sú tvorené vyššie uvedenými prvkami
Na chemické prvky a chemické zlúčeniny. Chemické zlúčeniny sú tvorené vyššie uvedenými prvkami Každý chemický prvok zodpovedá špecifickému atómu a iba s týmto typom atómu; to znamená, že chemický prvok nemá rôzne typy atómov. Atóm je elementárna častica hmoty, ktorá nie je rozdelená fyzikálnymi alebo chemickými metódami.
Atóm chemického prvku môže byť spojený s atómami iných chemických prvkov za vzniku chemických zlúčenín, ktoré sa môžu rozdeliť na ich zložky (chemické prvky) pomocou chemických metód.
Chemické prvky a chemické zlúčeniny s hádankou by mohli byť vybavené: kúsky skladačky majú rôzne vlastnosti, takže sa môžu zhodovať s chemickými prvkami.
Kusy puzzle sa môžu spojiť a vytvárajú rôzne postavy. Formované čísla sa môžu porovnávať s chemickými zlúčeninami. Akonáhle je aktivita dokončená, figúrky puzzle môžu byť rozdelené do kúskov, ktoré ju tvoria.
Príklady chemických zlúčenín
Nižšie nájdete sériu príkladov denných chemických zlúčenín:
- HCL: kyselina chlorovodíková
- H2S: kyselina sulfhydrová
- HF: Kyselina fluorhydrová
- H2SW4: Kyselina sírová
- HCLO4: Kyselina chlorová
- H3Po4: Kyselina fosforečná
- H2Co3: Kyselina uhličitá
- Hned3: Kyselina dusičná
- NaOH: hydroxid sodný
- CA (OH)2: Hydroxid vápenatý
- Viera (oh)2: Hydroxid železitý
- Viera (oh)3: Železitý hydroxid
- NAH: Hydrid sodný
- Cu2O: Cuprous Oxid
- Cuo: Cupric Oxid
- Vernosť2Ani3: Oxid železitý
- Cl2Ani7: Oxid perchlorický
- Br2O: hipobromózny oxid
- Jo2Ani3: Oxid hypoyodózy
- NaCl: chlorid sodný
- Fecl3: Chlorid železitý
- HCO3: Hydrogenuhličitan sodný
- Chvály3Cesta: octat sodný
- Nat2SW4: Sulfát sodný
- Feso4: Sulfid železnice
- H2O: Voda
- Co2: Oxid uhličitý
- C6H12Ani6: Glukóza
- C12H22Anijedenásť: Sacharóza
Ostatné témy, ktoré sú predmetom záujmu
Chemické reakcie
Chémia v každodennom živote: príklady
Organické zlúčeniny
Anorganické zlúčeniny
Chemická väzba
Čisto látka
Odkazy
- Whitten, Davis, Peck & Stanley. (2008). Chémia. (8. vydanie.). Učenie sa.
- Wikipedia. (2021). Chemická zlúčenina. Zdroj: In.Wikipedia.orgán
- HelMestine, Anne Marie, PH.D. (27. augusta 2020). Definícia zlúčeniny v chémii. Zotavené z: Thoughtco.com
- Tobolka. (s.F.). Čo je zlúčenina v chémii? Typy chemickej zlúčeniny. Získané z: Toppr.com

