Štruktúra chloridu ortuti (ii), vlastnosti, získanie, použitie, použitia

- 901
- 263
- MUDr. Žigmund Boška
On Chlorid ortuti (II) Je to anorganická zlúčenina tvorená atómom kovovej ortuti (HG) a dvoma atómami halogénu chlóru (CL). Ortuť je vo svojom oxidačnom stave +2 a chlóru -1.
Jeho chemický vzorec je HGCL2. Je to mierne prchavá kryštalická tuhá látka pri teplote miestnosti. Odbory medzi ich atómami sú kovalentnejšie ako iónové.
 Chlorid ortuti (II). MRGreen71/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons.
Chlorid ortuti (II). MRGreen71/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/3.0). Zdroj: Wikimedia Commons. Pri rozpustení vo vode si zachováva svoju molekulárnu štruktúru. Je tiež rozpustný v niekoľkých organických rozpúšťadlách. Svetlom svetla má tendenciu tvoriť kovovú ortuť.
V minulosti sa používalo ako antiseptikum a na liečbu určitých infekčných chorôb, u ľudí aj zvierat. Tiež ako insekticíd na kontrolu škodcov, ako sú mravce a termity.
Keď sa však overuje ich vysoká toxicita, väčšina z týchto použití bola opustená a v súčasnosti sa používa iba v laboratóriách chémie alebo biochemickej analýzy.
Môže využívať za určitých podmienok. Je to jedovatá zlúčenina, spôsobuje škodu ľuďom, zvieratám a rastlinám. Nikdy by sa nemalo vyradiť do životného prostredia. Je tiež podozrivý z karcinogénu.
[TOC]
Štruktúra
Chlorid ortuti sa skladá z Hg v oxidácii II a chlóru s valencia -1. V tomto haluro majú väzby medzi atómami veľmi výrazný kovalentný charakter.
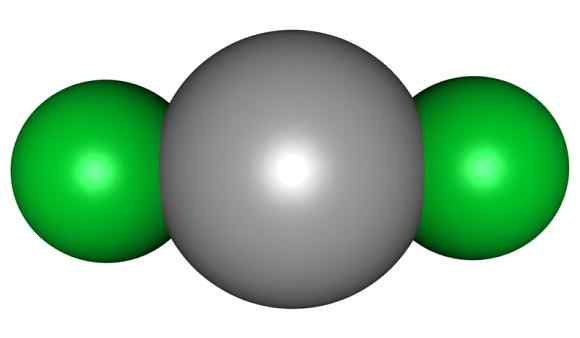 Hgcl molekula2. Šedá = ortuť; Zelený = chlór. Šípky / verejná doména. Zdroj: Wikimedia Commons.
Hgcl molekula2. Šedá = ortuť; Zelený = chlór. Šípky / verejná doména. Zdroj: Wikimedia Commons. To znamená, že v skle si zlúčenina udržiava svoju molekulárnu štruktúru CL-HG-Cl, kde je vzdialenosť HG-C-CL podobná, keď je v plynnom stave, zatiaľ čo v skle je vzdialenosť s atómami chlóru iných molekúl veľa starší.
 Usporiadanie molekúl HGCL2 V pohári. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons.
Usporiadanie molekúl HGCL2 V pohári. Benjah-Bmm27 / verejná doména. Zdroj: Wikimedia Commons. V plynnom stave je jasne molekulárny a tiež vo vodnom roztoku.
Menovanie
- Chlorid ortuti (II)
- Chlorid ortuť
- Bichlorid ortuti
- Dicloromercurio
Vlastnosti
Fyzický stav
Biele kryštalické tuhé, rombické kryštály.
 Pevný chlorid ortuť. Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons.
Pevný chlorid ortuť. Leiem/CC BY-SA (https: // creativeCommons.Org/licencie/By-SA/4.0). Zdroj: Wikimedia Commons. Molekulová hmotnosť
271,5 g/mol
Bod topenia
280 ° C
Sublimačný bod
Pri 300 ° C sublima, to znamená, že ide priamo z plynovej pevnej látky.
Hustota
5,6 g/cm3
Rozpustnosť
Little Water Rozpustný: 7,31 g/100 ml pri 25 ° C. Rozpustný alkohol: 33 g/ 100 ml pri 25 ° C. Rozpustný etylacetát. Malé rozpustné v éteri: 4 g/100 ml. Niečo rozpustné v benzéne.
Môže vám slúžiť: Helmholtz Free Energy: Jednotky, ako sa vypočítava, vyriešené cvičeniapH
Roztok 0,2 mol/l má pH 3,2-4,7.
Chemické vlastnosti
Vo vodnom roztoku je takmer výlučne (∼ 99%) vo forme molekuly HGCL2. Trpí však určitú hydrolýzu:
Hgcl2 + H2Alebo ⇔ hg (OH) cl + h+ + Cl-
Hgcl2 + 2 h2Alebo ⇔ hg (oh)2 + 2 h+ + 2 cl-,
Predstavuje výraznú rozpustnosť v organických rozpúšťadlách, kde má formu dimérov, to znamená dve viazané molekuly.
V prítomnosti organických látok a pôsobením slnečného žiarenia je znížená formovanie chloridu ortuti (I) (HGCL) a potom kovová ortuť.
Hgcl2 + Slnečné svetlo → HGCL → HG0
S roztokom hydroxidu sodného (NAOH) generuje žltú zrazeninu prekurmu (HGO) (HGO).
Je nekompatibilný alebo reaguje s formami, sulfitmi, fosfátami, sulfidmi, želatínou, albumínom, alkalisom, amoniakom, hydroxidom vápenatého, bromidmi, uhličitanymi, železom, meďou, olovami, striebornými soľami a niektorými rastlinnými materiálmi.
Ďalšie vlastnosti
Kvôli inému pre svoj najslužnejší ako iónový charakter je mierne prchavá pri teplote miestnosti a je značne prchavá pri 100 ° C.
Získanie
Môžete pripraviť oxidačnú kovovú ortuť (hg0) s chlórovým plynom (CL2). Pri zahrievaní a dosahovaní viac ako 300 ° C sa objaví plameň a odobraté pary sa sublimuje a keď sa tvoria kryštály HGCL2.
HG + CL2 + Teplo → HGCL2
Získava sa tiež zahrievaním sulfátu ortuti (II) suchý chloridom sodným. Pary hgcl2 že subliman sa zhromažďuje a kondenzuje na kryštalickú pevnú látku.
Hgso4 + 2 NaCl → HGCL2 + Nat2SW4
Reakcia medzi oxidom ortuti (II) s kyselinou chlorovodíkovou v stechiometrických množstvách produkuje kryštály HGCL2 Keď je médium ochladené.
HGO + 2 HCI → HGCL2 + H2Ani
Kryštály sa dajú purifikovať rekryštalizáciou a sublimáciou.
Žiadosti
V chemických laboratóriách
Používa sa ako činidlo v rôznych chemických analýzach. Umožňuje prípravu iných zlúčenín ortuti, ako je ortuťový jodid (II), oxid ortuť (II), chlorid ortuti (I), amónny a chlorid ortuti (II).
Môže vám slúžiť: fluorid: História, vlastnosti, štruktúra, získanie, riziká, použitieV patologických laboratóriách
Je súčasťou acetického roztoku Zenker, ktorý sa používa na liečbu vzoriek alebo vzoriek biopsií kostnej drene. Tkanivá sú rýchlo nastavené s vynikajúcimi histologickými detailmi, ktoré sa majú pozorovať pomocou mikroskopu.
 Niekedy HGCL2 Používa sa v patologických laboratóriách. Autor: Ernesto Eslava. Zdroj: Pixabay.
Niekedy HGCL2 Používa sa v patologických laboratóriách. Autor: Ernesto Eslava. Zdroj: Pixabay. Opustené použitie
V stredoveku a až do začiatku XX sa používa v rôznych aplikáciách, pretože jeho škodlivý účinok na zdravie nebol známy.
- Ako liečba určitých chorôb, lokálne antiseptické a dezinfekčné prostriedky.
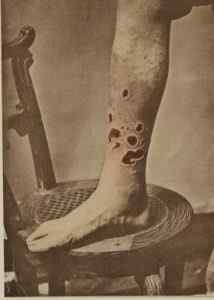 V minulosti HGCL2 Syfilis sa použil na liečbu. G. H. Doména FOX / Public Doména. Zdroj: Wikimedia Commons.
V minulosti HGCL2 Syfilis sa použil na liečbu. G. H. Doména FOX / Public Doména. Zdroj: Wikimedia Commons. - Vo veterinárnej medicíne ako žieravecký, dezinfekčný a antiseptický čin.
- V poľnohospodárstve pôsobil ako fungicíd, na kontrolu pozemných červov, ako je insekticíd a odpudzujúci šváb, mravce a termity a ako dezinfekčný prostriedok na ochranu semien a žiaroviek.
- Na ochranu dreva, chemické činidlo na balzamovanie a zachovanie anatomických vzoriek.
- Ako katalyzátor pri získavaní vinylchloridu z acetylénu.
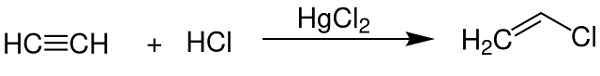 Chlorid ortuť (II) slúži ako katalyzátor pri získavaní niektorých chemických zlúčenín. Chem Sim 2001 / verejná doména. Zdroj: Wikimedia Commons.
Chlorid ortuť (II) slúži ako katalyzátor pri získavaní niektorých chemických zlúčenín. Chem Sim 2001 / verejná doména. Zdroj: Wikimedia Commons. - V hliníkovej elektróde.
- Označenie železa a ocele.
- Ako fotografické činidlo.
- V tkaninách tlače, ako mordant pre králiky a kožušinu pre drevené farbivo.
- Ako súčasť sušených batérií.
Riziká
Do zdravia
Je to korozívna a extrémne toxická zlúčenina, ak je požitá, pretože môže spôsobiť smrť. Útočí na gastrointestinálny trakt a renálny systém. Spôsobiť silné popáleniny na koži a očiach.
Predĺžené alebo opakované vystavenie tejto zlúčenine spôsobuje poškodenie vnútorných orgánov. Všetky formy ortuti sú jedovaté a HGCL2 je jedným z najviac toxických.
Existuje podozrenie, že je to karcinogén, ktorý spôsobuje genetické defekty a poškodenie plodnosti.
Oheň
Aj keď to nie je palivo, môže explodovať pri aplikácii tepla. Keď rozkladá toxické a ortuťové toxické plyny.
Zmesi HGCL2 S alkalickými kovmi, ako je sodík alebo draslík. Ak prídete do kontaktu s amoniakom, môžu explodovať aj sulfidy, kyselina oxalová a acetylén.
Môže vám slúžiť: kyselina chlorovodíková (HCL)Účinky na životné prostredie
Je veľmi toxický pre vodné a pozemné organizmy, jeho účinky trvajú v priebehu času. Môže prezentovať bioakumuláciu v celom potravinovom reťazci, a to v rastlinách aj zvieratách.
 Chlorid ortuť by sa nikdy nemalo vyradiť v prostredí. Autor: Naadjuuh. Zdroj: Wikimedia Commons.
Chlorid ortuť by sa nikdy nemalo vyradiť v prostredí. Autor: Naadjuuh. Zdroj: Wikimedia Commons. Ovplyvňuje dýchanie, fotosyntézu a ďalšie metabolické cesty rastlín, ktoré spôsobujú ich zhoršenie. Jeho dispozícia v prostredí (voda ani pôda ani atmosféra) by nemalo byť ovplyvnené) nemalo by byť ovplyvnené).
Nebezpečná prítomnosť v niektorých prírodných liečebných prostriedkoch
Napriek svojej toxicite existujú prírodné lieky a bylinky, ktoré ich obsahujú, takže ľudia, bez toho, aby to vedeli, sú nebezpečne vystavení tejto zlúčenine.
Napríklad v tradičnej čínskej medicíne Calomel alebo Qing Fen obsahuje nejaké HGCL2. Je to liek používaný ako diuretikum, antiseptické, kožné masť, preháňanie a externe aplikované na nepohodlie zubného zubného zubného zubného konania.
 Niektoré OSN kontrolované prírodné lieky môžu obsahovať HGCL2. Autor: Silvija bytosti. Zdroj: Pixabay.
Niektoré OSN kontrolované prírodné lieky môžu obsahovať HGCL2. Autor: Silvija bytosti. Zdroj: Pixabay. Odkazy
- Alebo.Siež. Lekárska knižnica. (2019). Chlorid ortuť. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Lester, s.C. (2010). Spracovanie vzoriek. Zenker's Acetic Fixation (Orange). V príručke chirurgickej patológie (tretie vydanie). Zotavené z vedeckých pracovníkov.com.
- Clarksson, T.W. (2001). Činiteľ. Fyzikálne a chemické vlastnosti. V Handbook of Peticíd toxikológia (druhé vydanie). Zotavené z vedeckých pracovníkov.com.
- Fretham, s.J.B. a kol. (2015). Ortuť a neurodegenerácia. Prírodné lieky a bylinky obsahujúce HG. V biologických nutraceutikách a doplnkoch výživy pri neurogických a mozgových ochoreniach. Zotavené z vedeckých pracovníkov.com.
- Rytier, s. a kol. (2014). Distribúcia a množstvo vodných rastlín - ľudské vplyvy. Chemické obdĺžniky. V referenčnej modulácii v zemských systémoch a environmentálnych vedách. Zotavené z vedeckých pracovníkov.com.
- Olovo, D.R. (Editor) (2003). Príručka chémie a fyziky CRC. 85th CRC Press.
- Bavlna, f. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chémia. Štvrté vydanie. John Wiley & Sons.
- Ciavatta, L. a Grimaldi, m. (1968). Hydrolýza chloridu ortuti (II), HGCL2. Journal of Anorganic and Jadring Chemistry, Zväzok 30, vydanie 2, február 1968, strany 563-581. Zotavené z vedeckých pracovníkov.com.
- Nadácia Wikimedia (2020). Ortuť (ii) chlorid. Získaný z.Wikipedia.orgán.
- « 21 mexických vedcov a ich historické príspevky
- Merkúr fulminate štruktúru, vlastnosti, získanie, použitia »

