Kyselina vínna
- 1475
- 175
- MUDr. Miloslav Habšuda
Vysvetľujeme, čo je kyselina z tartarovej, jej fyzikálne a chemické vlastnosti, jej štruktúra a jej aplikácie
Čo je kyselina z tartarovej?
On kyselina vínna Je to organická zlúčenina, ktorej molekulárny vzorec je COOH (CHOH)2Kohútik. Má dve karboxylové skupiny; To znamená, že môžete vydať dva protóny (h+). Inými slovami, je to diprotická kyselina. Môže sa tiež klasifikovať ako kyselina aldarová (kyslý cukor) a derivát kyseliny suktinovej.
Jeho soľ je známa od nepamäti a predstavuje jeden zo sekundárnych výrobkov rozpracovania vína. Kryštalizuje sa ako biely sediment pokrstený ako „diamanty vín“, ktoré sa hromadia v korku alebo na spodnej časti sudov a fliaš. Táto soľ je biitarrát draselného (alebo tartrato kyselina draselná).
Soli kyseliny z tartarovej majú spoločnú prítomnosť jedného alebo dvoch katiónov (NA+, Klimatizovať+. NH4+, Ac2+, atď.) Pretože uvoľnením svojich dvoch protónov zostáva negatívne nabité zaťažením -1 (ako s biterrato soľami) alebo -2.
Táto zlúčenina bola zase predmetom štúdia a výučby organických teórií týkajúcich sa optickej aktivity, presnejšie so stereochémiou.
Kde je kyselina z tartarovej?
Kyselina z tatárovej je zložkou mnohých rastlín a potravín, ako sú marhuľové, avokádo, jablká, tamarindos, slnečnicové semená a hrozno.
V procese starnutia vína sa táto kyselina - k chladu - kombinuje s draslíkom, aby sa kryštalizovala ako tatrato. V červených vínach je koncentrácia týchto tartratov menšia, zatiaľ čo v bielych vínach sú hojnejšie.
Tartráty sú soli bielych kryštálov, ale keď sú nečistoty alkoholického prostredia, získavajú červenkasté alebo fialové tóny.
Môže vám slúžiť: reakcia na posunŠtruktúra kyseliny z kameňa
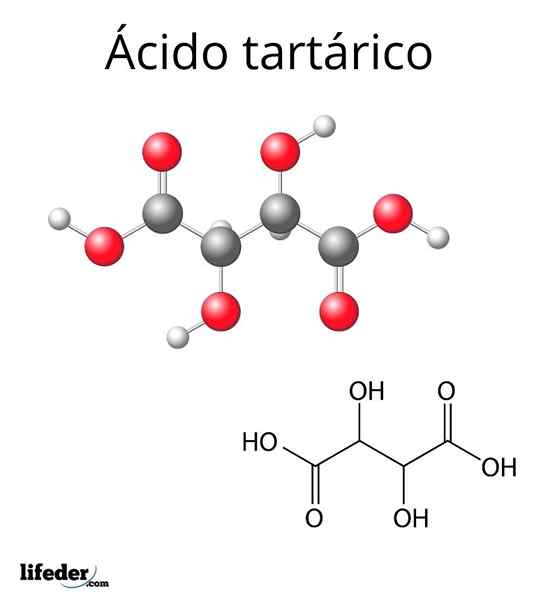
 Molekulárna štruktúra kyseliny z tartarovej
Molekulárna štruktúra kyseliny z tartarovej Molekulárna štruktúra kyseliny z tartarovej je znázornená na hornom obrázku. Karboxylové skupiny (-COOH) sú umiestnené na bočných koncoch a sú oddelené krátkymi dvoma uhlíkovými reťazcami (C2 a c3).
Každý z týchto uhlíkov je zase spojený s H (biela guľa) a OH skupina. Táto štruktúra môže otočiť odkaz C2-C3, tak generuje niekoľko konformácií, ktoré stabilizujú molekulu.
To znamená, že centrálne spojenie zlomenej molekuly ako rotujúci valc, ktorý sa postupne striedal priestorové dispozície skupín -COOH, H a OH (Newmanove projekcie).
Napríklad na obrázku dve skupiny OH smerujú opačným smerom, čo znamená, že sú v anti pozíciám medzi sebou. To isté platí pre skupiny -cooh.
Ďalšou možnou konformáciou je konformácia niekoľkých zatmených skupín, v ktorých sú obe skupiny orientované rovnakým smerom. Tieto konformácie by nehrávali dôležitú úlohu v štruktúre zlúčeniny, ak by všetky skupiny uhlíkov C2 a c3 Boli rovnaké.
Rovnako ako v tejto zlúčenine sú štyri skupiny odlišné (-COOH, OH, H a druhá strana molekuly), uhlíky sú asymetrické (alebo chirály) a vykazujú slávnu optickú aktivitu.
Spôsob, akým sú skupiny usporiadané do uhlíkov2 a c3 kyseliny z tatárovej určuje niektoré rôzne štruktúry a vlastnosti pre tú istú zlúčeninu; to znamená, že umožňuje existenciu stereoizomérov.
Aplikácie kyseliny zborovej
V potravinárskom priemysle
Používa sa ako stabilizátor Eulsion v pekárňach. Používa sa tiež ako prísada pre kvasinky, džem, želatínu a nealkoholické nápoje. Spĺňa tiež funkciu ako okyslenie, knižnica a uchádzač iónov.
Môže vám slúžiť: bromid sodný (NABR)V týchto potravinách sa nachádza kyselina z tartarovej: sladké sušienky, cukríky, čokolády, plynné tekutiny, pekárske výrobky a vína.
V rozpracovaní vín sa používa na zvýšenie vyváženia, z hľadiska nárazu, znížením týchto pH.
Vo farmaceutickom priemysle
Používa sa na vytváranie tabliet, antibiotík a šumivých tabliet, ako aj v liekoch používaných pri liečbe srdcových chorôb.
V chemickom priemysle
Používa sa vo fotografii, ako aj v galvanotechnike a je ideálnym antioxidantom pre priemyselné tuky.
Používa sa tiež ako únosca kovového iónu. Ako? Otáčanie ich odkazov takým spôsobom, že môžete nájsť atómy kyslíka v karbonylovej skupine bohatých na elektróny, okolo týchto pozitívne naložených druhov.
V stavebníctve
Odkladajte proces kalenia omietky, cementu a omietky, čím sa manipulácia s týmito materiálmi účinnejšia.
Vlastnosti kyseliny zborovej

Najbežnejšie aplikácie kyseliny zborovej sú:
- Kyselina z tatárovej sa predáva vo forme kryštalického prášku alebo mierne nepriehľadných bielych kryštálov. Má príjemnú chuť a táto nehnuteľnosť svedčí o kvalitnom víne.
- Roztavuje sa pri 206 ° C a horí pri 210 ° C. Je veľmi rozpustný vo vode, alkoholu, základných roztokoch a boraxe.
- Jeho hustota je 1,79 g/ml pri 18 ° C a predstavuje dve konštanty kyslosti: PKA1 a pka2. To znamená, že každý z týchto dvoch kyselín má svoju vlastnú tendenciu oslobodiť sa vo vodnom prostredí.
- Rovnako ako skupiny -COH a OH, môže byť analyzovaná infračervenou spektroskopiou (IR) pre svoje kvalitatívne a kvantitatívne stanovenia.
- Iné techniky, ako je hmotnostná spektroskopia a jadrová magnetická rezonancia, umožňujú predchádzajúcu analýzu tejto zlúčeniny.
Stereochémia

Kyselina z tatárovej bola prvá organická zlúčenina, do ktorej bolo vyvinuté enantiomérne rozlíšenie. Čo to znamená? Znamená to, že jeho stereoizoméry by sa mohli v roku 1848 manuálne oddeliť vďaka výskumnej práci biochemika Louisa Pasteura v roku 1848.
A aké sú stereoizoméry kyseliny z tartarovej? Sú to: (r, r), (s, s) a (r, s). R a s sú priestorové konfigurácie uhlíkov C2 a c3.
Kyselina z tatárovej (R, R), najprirodzenejšia, otáča polarizované svetlo doprava; Kyselina z tatárovej (S, S) je rozbitá doľava, na rozdiel od ihiel hodín. A nakoniec, kyselina z tatárovej (R, S) nerozbije polarizované svetlo, ktoré je opticky neaktívne.
Louis Pasteur s pomocou mikroskopu a pinzetu, nájdený a oddelený kryštály kyseliny z tartarovej, ktoré vykazovali „pravé“ a „ľavicové“ vzory, napríklad v vynikajúcom obraze.
Týmto spôsobom sú kryštály „vpravo -rukou“ kryštály tvorené enantiomérom (R, R), zatiaľ čo kryštály „ľavého ruky“ sú kryštály Enantiomer (S, S).
Kryštály kyseliny z tartarovej (R, S) sa však nelíšia od ostatných, pretože súčasne vykazujú kvalifikované a ľavicové charakteristiky; Preto nemohli byť „vyriešení“.
Odkazy
- Wikipedia. (2018). Kyselina vínna. Získaný z.Wikipedia.orgán
- Publikácia. (2018). Kyselina vínna. Obnovený z pubchem.Ncbi.NLM.NIH.Vláda.
- Pochopenie koláčov vína. Zotavené z jordanwinery.com
- Aktívny. Kyselina vínna. Zotavené z Actipedia.orgán
- Štrbina. Kyselina vínna. Pochteca sa zotavila.com.mx
- Dhanesshwar Singh a kol. (2012). O pôvode optickej nečinnosti kyseliny mezo-tartarovej. Katedra chémie, Manipur University, Canchipur, Imphal, India. J. Chem. Farmaceutický. Hovädzie mäso., 4 (2): 1123-1129.

