Kyselina
- 2445
- 350
- Gabriel Bahna
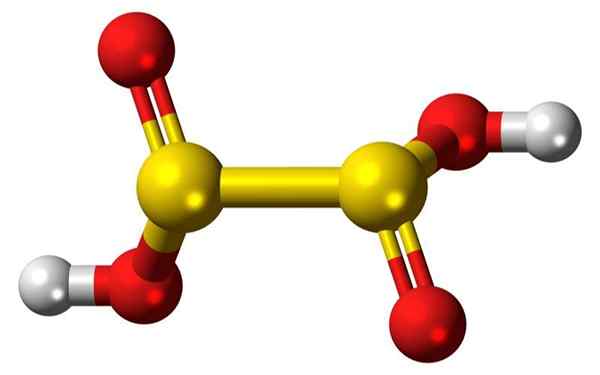
 3D tyčinky a balóniky molekuly hyposulfuróznej kyseliny. Zdroj: Jynto
3D tyčinky a balóniky molekuly hyposulfuróznej kyseliny. Zdroj: Jynto Čo je kyselina hyposulfurózna?
On Kyselina, o Kyselina dionová, nie je známa, nestabilne, nemá žiadnu nezávislú existenciu a nebola zistená vo vodnom roztoku.
Teoreticky by to bola relatívne slabá kyselina, porovnateľná s kyselinou sírovou, H2SO3. Sú známe iba ich soli, dionitos, ktoré sú stabilné a sú silné redukčné látky. Soľ kyseliny sodný sodný je dionito sodný.
Vzorce
Vzorce kyseliny hyposulfuróznej sú nasledujúce:
Kyselina diónová: H2Siež2Ani4
Dionito anión: S2O42—
Sodný dionito: NA2Siež2Ani4
CAS číslo: 20196-46-7 kyselina hyposulfurózna (alebo digital)
CAS číslo: 14844-07-6 Hyposulfurózna kyselina (alebo Dition, ión)
CAS číslo: 7775-14-6 dionito sodný (sodný sodný kyselina)
Fyzikálne a chemické vlastnosti
- V sodíkovej dionito soli je jej vzhľad kryštalický, biely až šedý prach, s vločkami svetla a slabej citrónovej zelenej síry.
- Molekulová hmotnosť ditatívnej kyseliny je 130.132 g/mol. Dionito anión, 128.116 g/mol a sodný dionito, 174.096 g/mol.
- V bode varu sodného dionito sa rozkladá a jeho bod topenia je 52 ° C.
- Hustota sodného dionito je 2.38 g/cm³ (bezvodý) a jeho rozpustnosť vo vode je 18.2 g/100 ml (bezvodý, 20 ° C).
- Kyselina hyposulfurózna je síra oxoacid s chemickým vzorcom h2Siež2Ani4.
- Síry oxoacidy sú chemické zlúčeniny, ktoré obsahujú síru, kyslík a vodík. Niektoré z nich sú však známe iba svojimi soľami (ako napríklad kyselina hyposírová, kyselina digová, kyselina disulfidová a kyselina síra).
Môže vám slúžiť: pyridín: štruktúra, vlastnosti, použitie, toxicita, syntézaMedzi štrukturálne charakteristiky oxoacidov máme:
- Tetraedrálna síra pri koordinovaní s kyslíkom.
- Atómy kyslíka v moste a termináli.
- Periodinálne skupiny.
- S = S Terminály.
- Reťazce (-s-) n
Kyselina sírová je najznámejšia síra oxoacid.
- Dionito anión ([s2Ani4] 2-) je oxoanion (ión s generickým vzorcom axoy z-) síry formálne odvodeného z kyseliny digínovej.
- Dionito ióny zažívajú kyslú aj alkalickú hydrolýzu na tiosíran a bisulfit a sulfit a sulfid.
- Soľ s kyselinou sodnou Dionová je dionit sodný (tiež známy ako hydrosulfit sodný).
- Môže byť získaný z bisulfitu sodného nasledujúcou reakciou:
2 Nahso3 + Zn → NA2SW4 + Zn (OH) ²
Žiadosti
Dionitový ión sa často používa v spojení s komplexným činidlom (napríklad kyselinou citrónovou), na zníženie železa oxi-hydroxidu (III) v rozpustných zlúčeninách železa (II) a eliminovanie amorfných minerálnych fáz, ktoré obsahujú železo (III) v pôde v pôde analýza (selektívna extrakcia).
Dionito umožňuje zvýšiť rozpustnosť železa. Vďaka silnej afinite iónového dionita pre bivalentné a trivalentné kovové katióny sa používa ako chelatačné činidlo.
Rozklad Dionito produkuje znížené druhy síry, ktoré môžu byť veľmi agresívne pre koróziu ocele a nehrdzavejúcej ocele.
Medzi aplikáciami sodného dionita máme:
V priemysle
- Táto zlúčenina je vo vode rozpustná soľ a môže sa použiť ako redukčné činidlo vo vodných roztokoch.
- Ako taká sa používa v niektorých procesoch priemyselného farbiva, najmä v tých, ktoré zahŕňajú farbivá a farbivá vane, v ktorých sa môže voda nerozpustné farbivo zredukovať na vodu rozpustná so soľou kovovej soli (napríklad indigo).
Môže vám slúžiť: kyseliny: Charakteristiky a príklady- Vlastnosti redukcie sodného Dionito tiež eliminujú nadbytočné farbivo, zvyškový oxid a nežiaduce pigmenty, čím sa zlepšuje globálna kvalita farieb.
- Dionito sodný sa môže tiež použiť na úpravu vody, čistenie plynu, čistenie a extrakciu. Môže sa tiež použiť v priemyselných procesoch, ako je sulfonantné činidlo alebo zdroj sodíka.
- Okrem textilného priemyslu sa táto zlúčenina používa v kožných odvetviach, potravinách, polyméroch, fotografii a mnohých ďalších. Používa sa tiež ako odfarbujúce činidlo v organických reakciách.
V biologických vedách
- Dionito sodný sa často používa vo fyziologických experimentoch ako prostriedok na zníženie redoxného potenciálu roztokov.
V geologických vedách
- Dionito sodný sa často používa v experimentoch chémie pôdy na určenie množstva železa, ktoré nie je začlenené do primárnych kremičitanových minerálov.
Bezpečnosť a riziká
Manipulácia s týmto prvkom sa musí vykonať v podmienkach extrémnej starostlivosti. Je mimoriadne toxický a môže nebezpečne reagovať v spojení s vodou a vzduchom.
Ďalej zdôrazňujeme niektoré aspekty.
Reakcie vzduchu a vody
- Dionito sodný je tuhé palivo, ktoré sa pomaly rozkladá, keď je v kontakte s vodou alebo vodnou parou a tvorí tiosíranty a bisulfity.
- Táto reakcia vytvára teplo, ktoré môže ďalej urýchliť reakciu alebo spôsobiť spaľovanie okolitých materiálov. Ak je zmes uväznená, reakcia rozkladu môže mať za následok tlak na nátlaku, ktorá sa môže silne rozbiť. Keď zostáva vo vzduchu, pomaly sa oxiduje a vytvára toxické plyny oxidu siričitého.
Môže vám slúžiť: Nitrofurans: Charakteristiky, mechanizmus činnosti a klasifikácieOheň
- Dionito sodný je horľavý a horľavý materiál. Môže byť zapálený pri kontakte s mokrým vzduchom alebo vlhkosťou. Môžete rýchlo horieť s efektom vo vzplanutí. Môže reagovať rázne alebo výbušne v kontakte s vodou.
- Sa dá rozbiť výbušne, keď sa zahrieva alebo je zapojený do ohňa. Môže sa znova zapnúť po tom, čo oheň zhasne. Odtok môže spôsobiť oheň alebo výbuch nebezpečenstva. Nádoby môžu po zahrievaní explodovať.
Zdravotné nebezpečenstvo
- Po príchode do kontaktu s ohňom bude dionito sodný produkovať dráždivé, korozívne a/alebo toxické plyny. Vdýchnutie výrobkov rozkladu môže spôsobiť vážne zranenia alebo smrť. Kontakt s látkou môže spôsobiť vážne popáleniny na koži a očiach. Odtok ovládacieho požiaru môže spôsobiť kontamináciu.
Odkazy
- Benjah-Bmm27 (2006). Model guľôčok dithionitého iónu [image] obnovený z.Wikipedia.orgán.
- Mlyny, b. (2009). Sodný-d-dištančný -xtal-1992-3d-gule [image] obnovený z: v.Wikipedia.orgán.

