Kyselina fosforečná (H3PO4)
- 4844
- 451
- Adrián Fajnor
 Jednotlivá molekula kyseliny fosforečnej
Jednotlivá molekula kyseliny fosforečnej Čo je kyselina fosforečná?
On kyselina fosforečná Je to kyselina oxo fosforu, ktorá má chemický vzorec h3Po4. Skladá sa z minerálnej kyseliny, v ktorej sú tri kyslé protóny spojené s fosfátovým aniónom (PO43-). Aj keď sa nepovažuje za silnú kyselinu, jej nevhodné použitie môže mať zdravotné riziko.
Nachádza sa v dvoch stavoch: ako tuhá látka vo forme hrubých ortorbických kryštálov alebo ako kryštalická tekutina vyzerajúca. Jeho najbežnejšia komerčná prezentácia má koncentráciu 85% P/P a hustotu 1 685 g/cm3. Táto hustota pochádza z ruky koncentrácie.
Tri OH skupiny sú zodpovedné za darovanie kyslých hydrogénov. Kvôli ich prítomnosti v ich štruktúre môžete reagovať s rôznymi hydroxidmi, ktoré spôsobujú niekoľko solí.
V prípade hydroxidu sodného môžete vytvoriť tri: monobazický fosforečnan sodný (NAH2Po4), Dibázický fosfát sodný (NA2HPO4) a kmeňový fosfát sodný (NA3Po4).
Avšak v závislosti od toho, ktorá základňa sa používa na neutralizáciu, alebo na to, aké katióny sú veľmi blízko, môžete tvoriť iné fosfátové soli. Medzi nimi patrí: fosfát vápenatý (CA3(PO4)2), Lítiumfosfát (li3Po4), železitý fosfát (FEPO4), a ďalšie. Každý s rôznymi stupňami protonácie fosfátového aniónu.
Na druhej strane, kyselina fosforečná môže „uniesť“ dvojmocné katióny, ako je viera2+, Cu2+, Ac2+ a mg2+. Pri vysokých teplotách môžete so sebou reagovať so stratou molekuly H2Alebo formovanie priemerov, zastrihávača a polyméry kyselín fosforečnej.
Tento typ reakcie spôsobuje, že táto zlúčenina je schopná vytvoriť veľké množstvo štruktúr s fosforom a kostrami kyslíka, z ktorých je možné získať aj širokú škálu známych solí, ako sú napríklad polyfosfáty.
Pokiaľ ide o jeho objav, v roku 1694 ho syntetizoval Robert Boyle (1627-1691), rozpustil p2Ani5 (Fosfor pentoxid) vo vode. Je to jedna z najužitočnejších minerálnych kyselín, čo je jej funkcia ako najdôležitejšie.
Fosfor, draslík a dusík tvoria tri hlavné živiny rastlín.
Štruktúra chemickej kyseliny fosforečnej
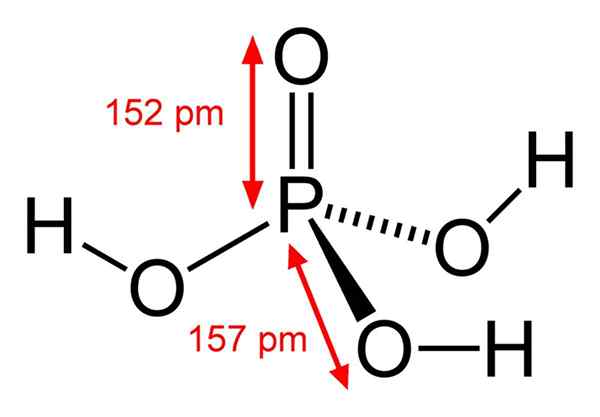
 Štruktúra chemickej kyseliny fosforečnej
Štruktúra chemickej kyseliny fosforečnej Kyselina fosforečná pozostáva z väzby p = o. S atómom fosforu v strede kyslík kreslí akýsi druh molekulárneho tetraedronu.
Týmto spôsobom sa môže kyselina fosforečná vizualizovať ako tetraedron. Z tohto hľadiska tieto tetraedra (podľa jednotiek H3Po4) interagovať medzi sebou vodíkovými mostmi; to znamená, že ich vrcholy úzko pristupujú.
Tieto intermolekulárne interakcie umožňujú kryštalický kryštalický kryštalický v dvoch tuhých látkach: bezvodý a hemihydrát (H3Po4· 1/2h2O), oba s monoklinickými kryštalickými systémami. Jeho forma anhydry sa dá opísať aj s vzorcom: 3H2Alebo · p2Ani5, čo sa rovná trojydratovanému pentoxidu fosforu.
Tetrahedra môže dokonca spájať kovalentne, ale preto musí jedna z jej jednotiek eliminovať molekulu vody dehydratáciou. K tomu dochádza, keď h3Po4 Podlieha zahrievaniu a vytvára v dôsledku tvorby polyfosférických kyselín (PA).
Kyselina diposforečná (h4P2Ani7)
Najjednoduchšie zo všetkých PA je kyselina diposforečná (H4P2Ani7), známa tiež ako kyselina pyrofosforečná. Chemická rovnica vašej formácie je nasledovná:
Môže vám slúžiť: hliníkový fosfát (ALPO4): Štruktúra, vlastnosti, získanie, použitia2h3Po4 H4P2Ani7 + H2Ani
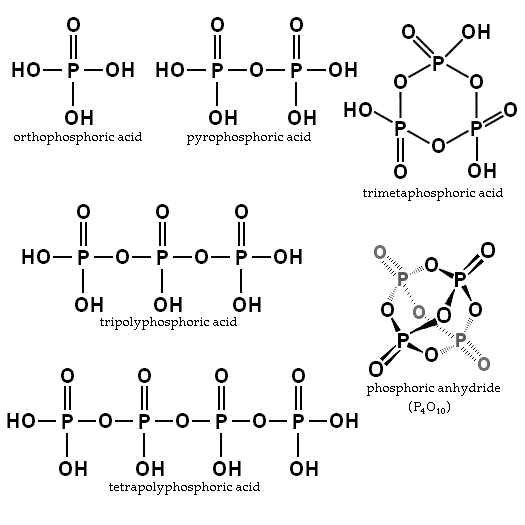
Rovnováha závisí od množstva vody a teploty. Aká je jeho štruktúra? Na obrázku sekcie sú štruktúry ortofosfahickej a kyseliny pyrofosforečnej ilustrované v ľavom hornom rohu.
Keď je eliminovaná molekula vody, sa kovalentne spájajú dve jednotky. Teraz to nie sú tri kyslé vodík, ale štyri (štyri skupiny -OH). Z tohto4P2Ani7 predstavuje štyri konštanty Kdo.
Kyseliny polyfosforečnice
Dehydratácia môže pokračovať s kyselinou pyrofosforečnou, ak bude zahrievanie pokračovať. Pretože? Pretože na každom konci svojej molekuly je skupina OH, ktorá sa dá eliminovať ako molekula vody, čím sa podporuje následný rast kostry P-O-O-O-P ... P ..
Príkladmi týchto kyselín sú tribosforečné a tetropoliforové kyseliny (obidve tiež ilustrované na predchádzajúcom obrázku). Je vidieť, ako sa kostra P-O-P predlžuje v akomsi reťazci tvorenej Tetrahedra.
Tieto zlúčeniny môžu byť reprezentované pomocou HO vzorca (PO2Oh)XH, kde je ho ľavý koniec, ktorý môže dehydratovať. Po2OH je kostra fosforu s odkazmi P = O a OH; A x sú jednotky alebo molekuly kyseliny fosforečnej potrebné na získanie uvedeného reťazca.
Ak sú tieto zlúčeniny úplne neutralizované, tak -zavolané polyfosfáty vznikajú. V závislosti od toho, ktoré katióny sú obklopené, tvoria širokú škálu polyfosfátových solí.
Na druhej strane, ak reagujú s alkoholmi ROH, sú vodiče ich kostry nahradené alkylovými substituentmi r-. Takto vznikajú fosfátové estery (alebo polyfyse): RO (PO2Alebo)XR. Stačí nahradiť H za R všetkými štruktúrami obrazu sekcie, aby sa ich získalo.
Cyklické kyseliny polyfosforečnice
Reťaze P-O-P sa môžu dokonca uzavrieť v cykle kruhu alebo fosforeku. Najjednoduchší z tohto typu zlúčeniny je kyselina trimetafosforečná (horný pravý roh obrazu). PA teda môžu byť lineárne, cyklické; alebo ak ich štruktúry vykazujú oba typy, rozvetvené.
Menovanie
 Kyselina fosforečná. Zdroj: Commons.Wikimedia.orgán
Kyselina fosforečná. Zdroj: Commons.Wikimedia.orgán Nomenklatúru kyseliny fosforečnej vládne IUPAC a ako sa pomenujú nulliové soli oxoacidy.
Pretože v h3Po4 Atóm P má Valencia +5, ten s najväčšou hodnotou, jej kyselina je priradená prípona -ico k predpone fosforu-.
Orto-
Kyselina fosforečná sa však bežne hovorí aj kyselina ortofosforečná. Pretože? Pretože slovo „orto“ je grécke a znamená „pravdivé“; čo by malo za následok „skutočnú formu“ alebo „hydratovanejšiu“ toho istého.
Keď je fosforečná anhydro hydratovaná prebytkom vody (P4Ani10, „Superior Image“ Cap “)3Po4 (3h2Alebo · p2Ani5). Preto sa orto predpona udeľuje kyselinami tvorenými hojnou vodou.
Piro-
Predpona PIRO sa týka každej zlúčeniny vznikajúcej po aplikácii tepla, pretože kyselina diposforečná vzniká z tepelnej dehydratácie kyseliny fosforečnej. Preto sa nazýva kyselina pyrofosforečná (2H2Alebo · p2Ani5).
Cieľ-
Cieľová predpona, ktorá je tiež grécke slovo, znamená „po“. Pridá sa k látkam, ktorých vzorec vylúčil molekulu, v tomto prípade vodou:
H3Po4 => HPO3 + H2Ani
Všimnite si, že tentoraz sa pri pridávaní dvoch fosforečných jednotiek nevyskytuje pri tvorbe kyseliny diposforečnej, ale namiesto kyseliny metafosforečnej sa získa (z ktorých neexistuje dôkaz o jej existencii).
Môže vám slúžiť: etylalkohol: štruktúra, vlastnosti, použitie, získanieJe tiež dôležité zdôrazniť, že táto kyselina sa dá opísať ako H2Alebo · p2Ani5 (Podobne ako hemidrate, vynásobenie HPO3 Pre 2). Predpona meta- je dokonale podľa cyklických PA, pretože ak sa kyselina tposforečná stane dehydratovanou, ale nepridáva ďalšiu jednotku H3Po4 Aby ste sa stali kyselinou tetrafosforečnou, musíte vytvoriť prsteň.
A to je to isté s ostatnými polymeetofosforečnými kyselinami, hoci IUPAC ich odporúča nazývať ich ako cyklické zlúčeniny zodpovedajúceho PAS.
Vlastnosti kyseliny fosforečnej
Molekulárna receptúra
H3Po4
Molekulová hmotnosť
97 994 g/mol
Fyzický vzhľad
Vo svojej tuhej podobe predstavuje orcombické, hygroskopické a priehľadné kryštály. V tekutej forme je kryštalická, s viskóznym sirupom.
Komerčne sa dosahuje vo vodnom roztoku s koncentráciou 85% p/p. Vo všetkých týchto prezentáciách chýba vôňa.
Body varu a fúzie
158 ° C (316 ° F A 760 mmHg).
108 ° F (42,2 ° C).
Rozpustnosť
548 g/100 g z h2Alebo 20 ° C; 369,4 g/100 ml pri 0,5 ° C; 446 g/100 m pri 14,95 ° C.
Hustota
1 892 g/cm3 (pevné); 1 841 g/cm3 (100%roztok); 1685 g/cm3 (85%roztok); 1 334 g/cm3 50%roztok) pri 25 ° C.
Hustota pary
Vzduch relatívny 3,4 (vzduch = 1).
Vlastné zapaľovanie
Nie je to horľavé.
Hrebeň
3,86 MPoise (40% až 20 ° C).
Kyslosť
PH: 1,5 (0,1 N roztok vo vode)
PKA: PKA1 = 2 148; PKA2 = 7,198 a PKA3 = 12 319. Preto je jeho najsahnejší vodík prvý.
Rozklad
Keď je zahrievaný, uvoľní oxidy fosforu. Ak teplota stúpa na 213 ° C alebo viac, stáva sa kyselinou pyrofosforečnou (H4P2Ani7).
Kričanie
Korozívne k železným kovom a hliníku. Pri reagovaní s týmito kovmi pochádza vodík horľavý plyn.
Polymerizácia
Násilne polymeriza s podvodmi, epoxidmi a polymerizovateľnými zlúčeninami.
Kyselina fosforečná používa
Fosfat a všeobecné využívanie predaja
-Kyselina fosforečná slúži ako základ pre rozpracovanie fosfátu, ktoré sa používajú ako hnojivá, pretože fosfor je hlavnou živinou rastlín.
-Používa sa pri liečbe vedúceho otravy a ďalších podmienok, v ktorých sú potrebné dôležité množstvá fosfátov a produkcia miernej acidózy.
-Používa sa na kontrolu pH močových ciest norok a mačiek, aby sa zabránilo tvorbe výpočtov obličiek.
-Kyselina fosforečná spôsobuje soli Na soli2HPO4 a nie2Po4 ktoré tvoria systém tlmiča pH s PKA 6,8. Tento regulačný systém pH je prítomný u ľudí, ktorý má význam pri regulácii intracelulárneho pH, ako aj pri liečbe koncentrácie vodíka v distálnych a kolektorových tubuloch nefronov.
-Používa sa na elimináciu mochosovej vrstvy oxidu železa, ktorá sa hromadí na tomto kovu. Kyselina fosforečná forma fosforečnanu, ktoré sa dajú ľahko odstrániť z kovového povrchu. Používa sa tiež v hliníkovom elektrickom leštení.
Priemyselný pracovník
-Kyselina fosforečná je určená ako katalytické činidlo pri vypracovaní nylonu a benzínu. Používa sa ako dehydratačné činidlo v litografickom gravírovaní, pri vypracovaní farbív na použitie v textilnom priemysle, v procese koagulácie latexu v pobrežnom priemysle a pri čistení peroxidu vodíka (peroxid vodíka).
-Kyselina sa používa ako prísada v nealkoholických nápojoch, ktoré týmto spôsobom prispievajú k svojej chuti. Zriedená, aplikuje sa v procese rafinácie cukru. Pôsobí tiež ako systém tlmiča nárazov pri príprave šunky, želatíny a antibiotík.
Môže vám slúžiť: hydroxid z hliníka: štruktúra, vlastnosti, použitia, riziká-Zasahuje do vypracovania detergentov, pri kyslej katalýze produkcie acetylénu.
-Používa sa ako kyslosť vo vyvážených potravinách pre hospodárske zvieratá a domáce zvieratá. Farmaceutický priemysel ho používa pri výrobe antiemetických liekov. Využíva tiež zmes na vytvorenie asfaltu na vydláždenie zeme a opravu prasklín.
-Kyselina fosforečná pôsobí ako katalyzátor pri hydratačnej reakcii alkénov na výrobu alkoholu, najmä etanolu. Okrem toho sa používa pri určovaní organického uhlia v pôdach.
Zubný
Používajú ju zubní lekári na čistenie a kondicionovanie zubného povrchu pred umiestnením zubných podperov. Nájde tiež použitie pri bielení zubov a eliminácii zubných dosiek. Okrem toho sa používa pri výrobe lepidla pre zubné protézy.
Kozmetika
Kyselina fosforečná sa používa na úpravu pH pri vypracovaní kozmetických výrobkov a starostlivosti o pleť. Používa sa ako chemické oxidačné činidlo na výrobu aktívneho uhlia.
Tvorba kyseliny fosforečnice
-Kyselina fosforečná sa pripravuje z hornín fosforečnanov typu apatitu prostredníctvom svojho koncentrovaného trávenia kyseliny sírovej:
Ac3(PO4)2 + 3 h2SW4 + 6 h2O => 2 h3Po4 + 3 (Prípad4.2h2Buď)
Kyselina fosforečná získaná v tejto reakcii je nízka čistota, takže sa podrobuje procesu čistenia, ktorý zahŕňa zrážanie, extrakciu rozpúšťadla, kryštalizáciu a techniky výmeny iónov.
-Kyselina fosforečná sa môže vyskytnúť rozpustením fosforu pentoxidu vo vriacej vode.
-Môže sa tiež získať zahrievaním fosforu so zmesou vzduchu a vodnej pary:
P4 (l) +5 o2 (g) => P4Ani10 (S)
P4Ani10 (s) +h2Alebo (g) => 4h3Po4 (L)
Riziká
-Pretože váš tlak pary je nízky pri teplote miestnosti, je nepravdepodobné, že by sa vaše výpary mohli vdýchnuť, pokiaľ sa kyselina nestriekajú. Ak áno, príznaky ich vdýchnutia zahŕňajú: kašeľ, bolesť hrdla, krátke a namáhavé dýchanie.
-V literatúre sa uvádza prípad námorníka, ktorý bol po dlhú dobu vystavený výparom kyseliny fosforečnej. Utrpel celkovú slabosť, suchý kašeľ, bolesť na hrudníku a problémy s dýchacími cestami. Po jednom roku po výstave sa pozorovala reaktívna dysfunkcia respiračného traktu.
-Kožný kontakt s kyselinou fosforečnej môže spôsobiť začervenanie, bolesť, pľuzgiere a spaľovanie pokožky.
-Kontakt kyseliny s očami, v závislosti od jej koncentrácie a trvania kontaktu, môže v týchto, tkanivových korozívnych léziách alebo silných popáleninách s trvalým poškodením oka.
-Požitie kyseliny spôsobuje horieť v ústach a krku, nadriadený pocit za hrudnou kosťou, bolesť brucha, zvracanie, šok a kolaps.
Odkazy
- Kráľovská spoločnosť chémie. (2015). Kyselina fosforečná. Prevzatý z: ChemSpider.com
- Kanadské centrum pre ochranu zdravia a bezpečnosti. (1999). Kyselina fosforečná - účinky na zdravie. Prevzaté z: CCSSO.Ac
- Kyseliny.Info. (2018). Kyselina fosforečná „rozmanitosť použitia tejto chemickej zlúčeniny. Prevzaté z: kyseliny.Info
- James P. Smith, Walter E. Brown a James R. Lehr. (1955). Štruktúra kyseliny kryštalickej fosforečnej. J. Hod. Chem. SOC. 77, 10, 2728-2730
- Wikipedia. (2018). Kyseliny fosforečnej a fosfáty. Prevzaté z: v.Wikipedia.orgán
- Veda je zábava. Dozviete sa viac o kyseline fosforečnej. [PDF]. Prevzaté z: Scifun.Chem.Wisc.Edu

