Kyselina fosfor (H3PO3)
- 4974
- 835
- Tomáš Mydlo
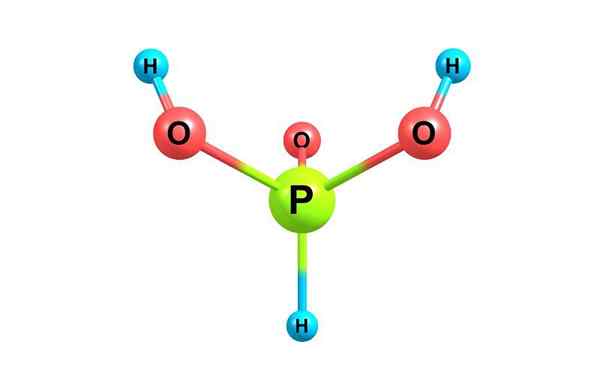
 Chemická štruktúra kyseliny fosforu. S licenciou
Chemická štruktúra kyseliny fosforu. S licenciou Čo je kyselina fosfor?
On kyselina fosfor, Tiež sa nazýva ortofosfvačná kyselina, je chemickou zlúčeninou vzorca h3Po3. Je to jedna z rôznych okysličených kyselín fosfor a jeho štruktúra je uvedená na hornom obrázku.
Vzhľadom na zloženú vzorec sa to dá prepísať ako HPO (OH)2. Tento druh existuje v rovnováhe s menším tautomérom P (OH)3.
Odporúčania IUPAC, 2005, sú, že táto sa nazýva kyselina fosfor, zatiaľ čo forma dihydroxy sa nazýva kyselina fosfónová. Iba znížené zlúčeniny fosforu sú kúzla s ukončením „medveďa“.
Kyselina fosfor je kyselina diprotická, to znamená, že má iba schopnosť poskytnúť dva protóny. Je to preto, že väčšina tautomér je H3Po3.
Keď táto forma stratí protón, rezonancia stabilizuje formované anióny. P (OH) Tautomero 3 nemá výhodu stabilizácie rezonancie. Vďaka tomu je eliminácia tretieho protónu oveľa ťažšie.
Kyselina fosforečná (H3Po3) Predaj nazývaný fosfity, ktoré sa používajú ako redukčné látky. Sa pripravuje rozpustením tetrafosforového hexoxidu (P4Ani6) Podľa rovnice:
P4Ani6 + 6 H₂o → 4 HPO (OH)2
Čistá kyselina fosfor, h3Po3, Lepšie je pripravená hydrolýzou trichloridu fosforu, PCL3.
Pcl3 + 3h2O → HPO (OH)2 + 3hcl
Výsledný roztok sa zahrieva na vylúčenie HCL a zvyšná voda sa odparuje, až kým sa neobjaví 3Po3 kryštalické farebné pri chladení. Kyselina sa dá získať aj pôsobením vody na PBR3 alebo pi3.
Fyzikálne a chemické vlastnosti kyselina fosfor
- Kyselina fosfor je biely alebo žltý hygroskopický tetraedrálny kryštál, s arómou podobnou cesnaku.
Môže vám slúžiť: Nenasýtené riešenie- H3Po3 Má molekulovú hmotnosť 82,0 g/mol a hustotu 1 651 g/ml.
- Zlúčenina má bod topenia 73 ° C a rozkladá sa nad 200 ° C.
- Je rozpustný vo vode a je schopný rozpustiť 310 gramov na 100 ml tohto rozpúšťadla. Je tiež rozpustný v etanole.
- Je to silná kyselina s PKA medzi 1,3 a 1,6.
- Zahrievanie kyseliny fosforu pri približne 200 ° C ju robí rozlíšenie na kyselinu fosforečnú a fosfínu (pH3). Fosfín je plyn, ktorý sa normálne zapne spontánne vo vzduchu.
4H3Po3 + Teplo → PH3 + 3h3Po4
Reaktivita a nebezpečenstvo
Reaktivita
- Kyselina fosfor nie je stabilná zlúčenina.
- Absorbovať kyslík vzduchu za vzniku kyseliny fosforečnej.
- Vytvorte žlté usadeniny vo vodnom roztoku, ktoré sú pri sušení spontánne horľavé.
- React exotermicky s chemickými základňami (napríklad: anorganické amíny a hydroxidy) za vzniku solí.
- Tieto reakcie môžu vytvárať nebezpečne veľké množstvo tepla v malých priestoroch.
- Rozpustenie vody alebo riedenie koncentrovaného roztoku s ďalšou vodou môžu vytvárať významné teplo.
- Reaguje v prítomnosti vlhkosti s aktívnymi kovmi, vrátane štrukturálnych kovov, ako je hliník a železo, na uvoľnenie vodíka, horľavého plynu.
- Môžete začať polymerizáciu určitých alkénov. Reaguje s kyanidovými zlúčeninami na uvoľnenie kyanidu plynného vodíka.
- Môže generovať horiace a / alebo toxické plyny v kontakte s ditiokarbamami, izociátmi, obchodníkmi, nitridami, nitrilmi, sulfidmi a silnými redukčnými činidlami.
- Ďalšie reakcie vytvárajúce plyny sa vyrábajú s sulfitmi, dusitanmi, tiosulfátmi (na poskytnutie H2 a SO3), dionitos (na poskytnutie SO2) a uhličitany (na poskytnutie CO₂).
Môže vám slúžiť: Einstenio (S): Štruktúra, vlastnosti, získavanie, použitie, použitiaNebezpečenstvo
- Zlúčenina je korozívna pre oči a pokožku.
- Očný kontakt môže mať za následok poškodenie rohovky alebo slepota.
- Kontakt kože môže spôsobiť zápal a pľuzgiere.
- Vdýchnutie prachu spôsobí podráždenie gastrointestinálneho alebo respiračného traktu, ktorý sa vyznačuje pálením, kýchaním a kašľaním.
- Závažné nadmerné vystavenie môže spôsobiť poškodenie pľúc, udusenie, stratu vedomostí alebo smrť.
Konanie v prípade poškodenia
- Uistite sa, že zdravotnícky personál je vedomý materiálov zapojených materiálov a prijíma bezpečnostné opatrenia na ochranu seba.
- Obeť sa musí presunúť na čerstvé miesto a zavolať na pohotovostnú lekársku službu.
- Ak obeť nedýcha, by sa malo podať umelé dýchanie.
- Metóda úst k ústam by sa nemala používať, ak sa obeť požila alebo vdýchla látka.
- Umelé dýchanie sa vykonáva pomocou vreckovej masky vybavenej jednosmerným ventilom alebo iným primeraným dýchacím zariadením.
- Kyslík by sa mal podávať, ak je dýchanie ťažké.
- Kontaminované oblečenie a topánky musia byť odstránené a izolované.
- V prípade kontaktu s látkou okamžite opláchnite pokožku alebo oči tečúcou vodou najmenej 20 minút.
- Pre kontakt s nižšími pokožkou by sa mal materiálu vyhnúť na nebatvenej pokožke.
- Udržujte obeť pokojnú a horúcu.
- Účinky expozície (vdýchnutie, požitie alebo kontakt s kožou) sa môžu oneskoriť.
Použitie kyselina fosfor
- Najdôležitejšie využitie kyseliny fosforu je produkcia fosfitov používaných pri úrade vody. Kyselina fosforečná sa tiež používa na prípravu fosfitových solí, ako je fosfit draselného.
Môže ti slúžiť: Boyle Law- Fosfity preukázali účinnosť pri kontrole rôznych rastlín.
- Najmä ošetrenie injekciou kmeňa alebo listu, ktorý obsahuje solí kyseliny fosforu, je indikované v reakcii na infekcie v dôsledku rastlinných patogénov fytoftera a typu pythium (vyvoláva rozklad koreňa).
- Kyselina fosfor a fosfity sa používajú ako redukčné činidlá v chemickej analýze. Nová pohodlná a škálovateľná syntéza kyselín fenylactových, prostredníctvom redukcie katalyzovanej jodidom kyseliny mandelovej, je založená na generovaní kyseliny jodidechovej z katalytického jodidu sodného z katalytického jodidu sodného. Na tento účel sa kyselina fosforečná používa ako stechiometrický reduktor.
- Používa sa ako zložka na výrobu prísad použitých v priemysle Poli (vinylchlorid). Estery kyseliny fosforu sa používajú aj pri niekoľkých reakciách organickej syntézy.
Odkazy
- Kyselina fosfor (H3PO3). Zotavené z Britannice.com.
- Kyselina. Zotavené z EBI.Ac.Uk.

