Kyselina
- 3674
- 1032
- Mgr. Pravoslav Mokroš
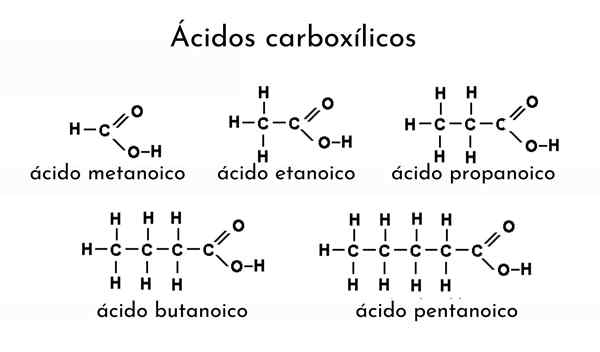
 Príklady karboxylových kyselín
Príklady karboxylových kyselín Čo sú karboxylové kyseliny?
On kyselina Je to termín pripisovaný akejkoľvek organickej zlúčenine obsahujúcej karboxylovú skupinu. Môžu sa tiež nazývať organické kyseliny a sú prítomné v mnohých prírodných zdrojoch. Napríklad z mravcov a iných hmyzu, ako je galleritový chrobák, kyselina mravčová, je destilovaná kyselina karboxylová.
To znamená, že anthill je zdroj bohatá na kyselinu mravčú. Kyselina octová sa tiež extrahuje z octu, vôňa žltého masla je spôsobená kyselinou butylovou, bylinky Valeria obsahujú mozgovú kyselinu a z čiapok získaných kyselinou kaprvicou, všetky tieto karboxylové kyseliny.
Kyselina mliečna dáva zlú chuť kyslého mlieka a v niektorých tukoch a olejoch sú prítomné mastné kyseliny. Príklady prírodných zdrojov karboxylových kyselín sú nespočetné množstvo, ale všetky ich pridelené mená sú odvodené od slov v latinčine. Tak, v latinčine slovo formica znamená „mravec“.
Pretože tieto kyseliny boli extrahované v rôznych kapitolách histórie, tieto názvy boli bežné a konsolidovali sa v populárnej kultúre.
Vzorec
Ten Všeobecný vzorec karboxylovej kyseliny je -r -coOH, alebo viac detailov: R- (c = o) -oh. Atóm uhlíka je spojený s dvoma atómami kyslíka, čo spôsobuje zníženie jeho elektronickej hustoty a následne pozitívne čiastočné zaťaženie.
Toto zaťaženie odráža stav oxidácie uhlíka v organickej zlúčenine. V akomkoľvek inom je uhlík rovnako hrdzavý ako v prípade karboxylových kyselín, pričom táto oxidácia je úmerná stupňu reaktivity zlúčeniny zlúčeniny.
Z tohto dôvodu má skupina -cOOH prevahu proti iným organickým skupinám a definuje hlavnú sýtenú povahu a hlavný sýtený reťaz zlúčeniny.
Preto neexistujú žiadne kyslé deriváty amínov (R-NH2), ale aminos odvodené z karboxylových kyselín (aminokyseliny).
Menovanie
Bežné názvy odvodené z latinčiny pre karboxylové kyseliny neobjasňujú štruktúru zlúčeniny alebo ich usporiadanie alebo dispozíciu svojich skupín atómov.
Vzhľadom na potrebu týchto objasnení vzniká systematická nomenklatúra IUPAC na pomenovanie karboxylových kyselín.
Môže vám slúžiť: Bromín: História, štruktúra, elektronická konfigurácia, vlastnosti, použitieTáto nomenklatúra sa riadi niekoľkými pravidlami a niektoré z nich sú:
Pravidlo 1
Ak chcete spomenúť kyselinu karboxylovú, názov jej alkánu sa musí upraviť pridaním prípony „ICO“. Preto pre etánu (zvoľte3-Chvály3) jej zodpovedajúca karboxylová kyselina je kyselina etanovú (CH3-CoOH, kyselina octová, to isté od octu).
Ďalší príklad: pre Cho3Chvály2Chvály2-Cooh El Alcano sa stáva bután (ch3Chvály2Chvály2Chvály3) a preto je menovaná kyselina butánová (kyselina butylová, rovnaká ako žltá maslo).
Pravidlo 2
Skupina -oH definuje hlavný reťazec a číslo zodpovedajúce každému uhlíku sa počíta z karbonylu.
Napríklad Cho3Chvály2Chvály2Chvály2-COOH je kyselina pentanoová, počíta sa od jedného do piatich uhlíkov do metylu (vyberte3). Keby bola iná metylová skupina spojená s tretím uhlíkom, bolo by to Cho3Chvály2Chváli3)2-COOH, ktorá je teraz výslednou nomenklatúrou: kyselina 3-metylpentánová kyselina.
Pravidlo 3
Substituentom predchádza počet uhlíka, ku ktorému sú spojené. Podobne tieto substituenty môžu byť dvojitými alebo trojitými odkazmi a pridať príponu „ICO“ rovnako do alkénov a alkínov. Napríklad Cho3Chvály2Chvály2Chch2-COOH sa spomína ako kyselina (CIS alebo trans) 3-heptenoic.
Pravidlo 4
Keď reťazec R pozostáva z krúžku (φ). Kyselina sa spomína počnúc názvom krúžku a končiac „karboxylovou“ príponou. Napríklad φ-COOH je pomenovaný ako kyselina benzecenokarboxylová.
Karboxylová štruktúra
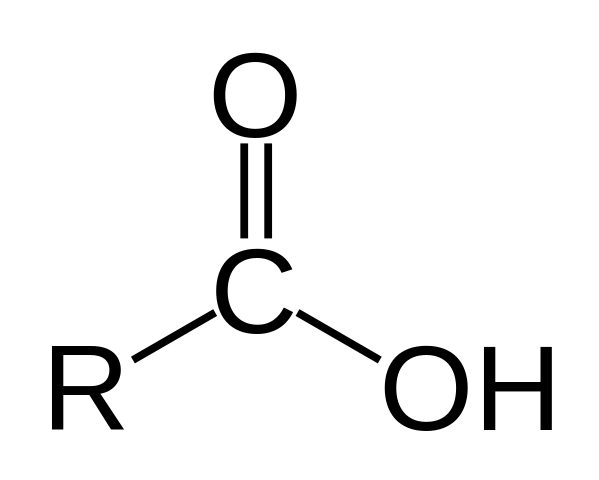 Štruktúra kyseliny karboxylovej. R je vodík alebo sýtený reťazec.
Štruktúra kyseliny karboxylovej. R je vodík alebo sýtený reťazec. Na hornom obrázku je reprezentovaná všeobecná štruktúra kyseliny karboxylovej. Bočný reťazec r môže byť v akejkoľvek dĺžke alebo má všetky druhy substituentov.
Atóm uhlíka má hybridizáciu SP2, čo vám umožňuje prijať dvojitú väzbu a generovať uhly spojenia približne 120 °.
Preto sa táto skupina môže asimilovať ako plochý trojuholník. Horný kyslík je bohatý na elektróny, zatiaľ čo dolný vodík je v elektronoch zlý a stáva sa kyslým vodíkom (elektrónový akceptor). Toto je pozorovateľné v dvojitých rezonančných štruktúrach.
Vodík je priradený k základni a z tohto dôvodu táto štruktúra zodpovedá kyslej zlúčenine.
Môže vám slúžiť: amínyVlastnosti karboxylovej kyseliny
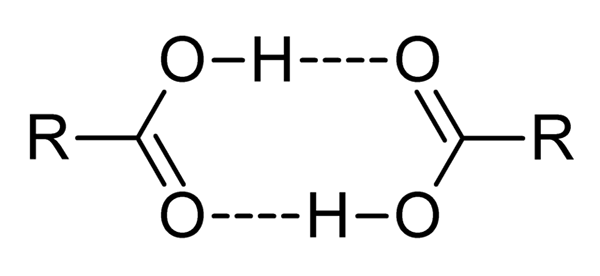
Karboxylové kyseliny sú veľmi polárne zlúčeniny, intenzívne zápach a s ľahkosťou efektívne interakcie medzi sebou vodíkovými mostmi, ako je znázornené vynikajúcim obrazom.
Keď týmto spôsobom interagujú dve karboxylové kyseliny, vytvoria sa Dímeros, niektoré dostatočne stabilné na to, aby existovali v plynnej fáze.
Vodík a priemer spôsobujú, že karboxylové kyseliny majú vyššie body varu ako voda. Dôvodom je skutočnosť, že energia poskytnutá v teple sa musí odpariť nielen molekula, ale aj dimér, tiež spojená s týmito vodíkovými mostmi.
Malé karboxylové kyseliny cítia veľkú afinitu k vodnému a polárnym rozpúšťadlám. Ak je však počet atómov uhlíka väčší ako štyri, prevažuje hydrofóbny charakter reťazcov R a stáva sa s vodou nemiešateľný.
V pevnej alebo kvapalnej fáze hrajú dôležitú úlohu dĺžka reťazca R a substituenty, ktoré má. Ak sú teda reťazce veľmi dlhé, interagujú medzi sebou cez londýnske disperzné sily, ako v prípade mastných kyselín.
Kyslosť
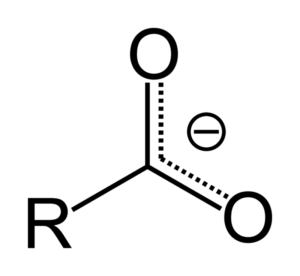
Keď karboxylová kyselina daruje protón, stáva sa karboxylátovým aniónom, ktorý je znázornený na hornom obrázku. V tomto aninii sa negatívne zaťaženie premiestni medzi dvoma atómami uhlíka, stabilizujú.
Ako sa mení táto kyslosť od jednej karboxylovej kyseliny do druhej? Všetko záleží na kyslosti protónu v OH skupine: Chudobnejší v elektronoch, tým viac kyseliny.
Táto kyslosť sa môže zvýšiť, ak je jedným z substituentov reťazca RA elektronegatívnym druhom (ktorý priťahuje alebo odstraňuje elektronickú hustotu z jej okolia).
Napríklad, ak v CHO3-COOH je nahradený H metylovej skupiny atómom fluóru (CFH2-COOH) Kyslosť sa značne zvyšuje, pretože F odstraňuje elektronickú hustotu z karbonylu, kyslíka a potom vodíka. Ak sú všetky H nahradené f (porovnaj3-COOH) Kyslosť dosahuje svoju maximálnu hodnotu.
Môže vám slúžiť: Vodík: História, štruktúra, vlastnosti a použitiaAká premenná určuje stupeň kyslosti? PKdo. Nižšie PKdo A bližšie k 1, väčšia je schopnosť kyseliny disociovať vo vode a následne nebezpečnejšia a škodlivejšia. Z predchádzajúceho príkladu, porovnaj3-COOH má najnižšiu hodnotu PKdo.
Použitie/aplikácie karboxylových kyselín
Kvôli obrovskej rozmanitosti karboxylových kyselín má každá z nich potenciálne použitie v priemysle, či už z polymérov, farmaceutických alebo potravín.
Potravinársky priemysel
- Prídavné látky.
- Konzervačné látky (kyselina sorbová a kyselina benzoová).
- Regulátor alkality mnohých výrobkov.
- Výroba nealkoholických nápojov.
- Antimikrobiálne látky pred pôsobením antioxidantov. V tomto prípade je trend tekutý antimikrobiálny.
- Hlavná zložka spoločného octu (kyselina octová).
- Kyslátňa v sýtených nápojoch a potravinách (kyselina citrónová a kyselina mliečna).
- Asistent pri dozrievaní švajčiarskeho syra (kyselina propiónová).
- Syr, Chucrut, fermentované colm a nealkoholické nápoje (kyselina mliečna).
Farmaceutický priemysel
- Antipyretiká a analgetiká (kyselina acetylsalicylová).
- Aktívny v procese syntézy arómy, v niektorých liekoch (butyrická alebo kyselina butánová).
- Antimikotická (kyselina benzoová kombinovaná s kyselinou salicylovou).
- Aktívny na výrobu liekov vitamínu C (kyselina askorbová).
- Fungicíd (kyselina kaprilová).
- Výroba niektorých preháňadiel (kyselina hydroxybothanodná).
Iné priemyselné odvetvia
- Výroba plastov a lubrikantov (kyselina sorbová).
- Výroba lakov, elastických živíc a priehľadných lepidiel (kyselina akrylová).
- Výroba obrazov a lakov (kyselina linolová).
- Výroba mydiel, detergentov, šampónov, kozmetických a čistiacich prostriedkov na čistenie kovov (kyselina olejová).
- Výroba zubných cestovín (kyselina salicylová).
- Výroba octanu, fotografické filmy a rozpúšťadlá pre farby (kyselina octová).
- Produkcia farbiva a opálené (kyselina metán).
- Príprava olejov z maziva, vodotesných materiálov a maľby sekundových (kyselina palmitová).
- Výroba gumy (kyselina octová).
- Gumové rozpracovanie a galvanoplastika.
- Solventný.
- Produkcia parfumov (kyselina benzoová).
- Výroba plastifikátorov a živíc (kyselina foto).
- Polyesterové rozpracovanie (kyselina tereftalová).
- Príprava parafínových sviečok (kyselina stearová).
Odkazy
- Graham Solomons t.W., Craig B. Fryhle. Organická chémia. Karboxylové kyseliny a ich deriváty (10. vydanie., Page 779-783). Wiley Plus.
- Organické kyseliny. Prirodzený výbor sa zotavil.com
- Francis a. Korytnačka. Organická chémia. Karboxylové kyseliny. (Šieste vydanie., Strana 805-820). MC Graw Hill.
- William Reusch. Karboxylové kyseliny. Získané z chémie.MSU.Edu

