Cycopropan (C3H6)
- 3610
- 550
- Tomáš Klapka
Čo je cyklopropán?
On Cyklistika Je to cyklická molekula, ktorá má molekulárny vzorec C3H6, a to sa skladá z troch atómov uhlíka spojených spolu vo forme kruhu. V chémii je rodina nasýtených uhľovodíkov, ktoré majú kostru tvorenú atómami uhlíka spojené s jednoduchými väzbami na tvare kruhu.
Táto rodina pozostáva z rôznorodého počtu molekúl (ktoré sa líšia podľa dĺžky jej hlavného sýteného reťazca) a je známe tým, že má rýchlejšie topenie a varné body ako v prípade vysokých reťazcov, okrem väčšej reaktivity ako tieto.
Cycropotus objavil v roku 1881 rakúsky chemik s názvom August Freund, ktorý bol odhodlaný vedieť, čo je toxický prvok v etyléne a ktorý si myslel, že to bol rovnaký cyklopropán.
Napriek tomu až do tridsiatych rokov 20. storočia sa začalo vyrábať na priemyselnej úrovni, keď objavili svoje použitie ako anestézia, pretože pred týmto okamihom neboli komerčnou príťažlivosťou.
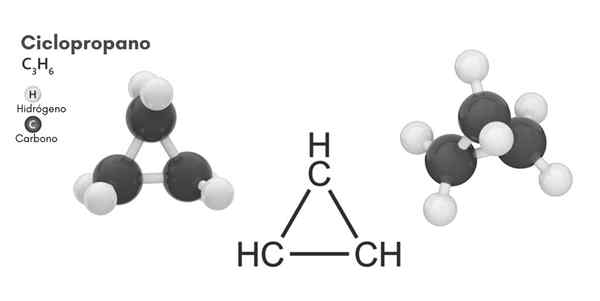
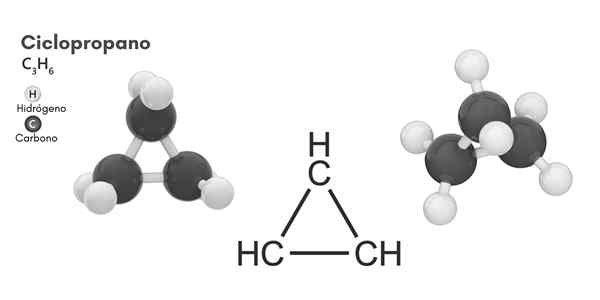
Chemická štruktúra
 Molekulárna štruktúra cyklopropánu
Molekulárna štruktúra cyklopropánu Cyklovanie, molekulárny vzorec C3H6, Pozostáva z troch malých atómov uhlíka, ktoré sa viažu v konfigurácii tak, že sa kruh vytvára a zanecháva molekulárnu symetriu d3h V každom uhlíku reťazca.
Štruktúra tejto molekuly vyžaduje, aby uhly spojenia tvorené od asi 60 °, oveľa menej ako 109,5 °, ktoré sa pozorujú medzi atómami hybridov SP3, čo je termodynamicky stabilnejšia.
To vedie k tomu, že kruh trpí výraznejším štrukturálnym napätím ako iné štruktúry tohto typu, okrem prírodného torzného napätia, ktoré má zatienenou konformáciou svojich atómov vodíka.
Môže vám slúžiť: enzymatická kinetikaZ toho istého dôvodu sú väzby, ktoré sa tvoria medzi atómami uhlíka v tejto molekule.
Zvláštnym spôsobom a na rozdiel od iných odkazov, kde blízkosť medzi dvoma molekulami symbolizuje väčšiu energiu spojenia, väzby medzi uhlíkom tejto molekuly majú zvláštnosť, že majú dĺžku nižšiu ako ostatné alkány (kvôli ich geometrii) a rovnakým čas sú slabší ako odbory medzi nimi.
Okrem toho cyklopropán.
Vlastnosti Cyclo
Bod varu
V porovnaní s ostatnými najbežnejšími cykloalcanos, cyklopropán.
Na druhej strane, v porovnaní s lineárnym propánom, cyklopropán.
Bod topenia
Bod fúzie cyklopropánu je menší ako bod ostatných cykloalcanov, ktorý sa topí pri teplote 128 ° C menší ako nula. Napriek tomu to nie je jediný cykloalcano, ktorý sa topí pri teplote menšej ako nula, pretože je schopný pozorovať tento jav aj v cyklobutáne, cyklopentane a cykloheptane.
Takže v prípade lineárneho propánu sa topí pri teplote menšej ako 187 ° C pod nulou.
Hustota
Cycropopán má najvyššiu hustotu medzi cykloalcanos, čo je viac ako dvakrát do najhustejšieho spoločného cyklu (1 879 g/l pre cyklopropán, čím prekonal cyklodecano 0,871).
Môže vám slúžiť: oxid hliníka: štruktúra, vlastnosti, použitie, nomenklatúraV cyklopropáne je tiež vyššia hustota ako v lineárnom propáne. Rozdiel v bodoch varu a fúzie medzi lineárnymi a cykloalcanovými alkánmi je spôsobený väčšími londýnskymi silami, ktoré sa zvyšujú v dôsledku kruhovej formy, ktorá umožňuje väčšiu kontaktnú plochu medzi vnútornými atómami.
Reaktivita
Reaktivita cyklopropánu.
Vďaka tomu môže byť cyklopropán ľahšie oddelený a v určitých reakciách sa môže správať ako Alqueno. V skutočnosti sa môže extrémna reaktivita zmesí cyklopropánu a kyslíka stať nebezpečenstvom výbuchu.
Použitie/aplikácie
Komerčné využitie cyklopropánu par excellence je ako anestetický agent, ktorý túto vlastnosť študuje prvýkrát v roku 1929.
Cyclo -wine je silným anestetickým činidlom rýchleho pôsobenia, ktoré nepráca dýchací trakt alebo predstavuje zápach. Počas chirurgických zákrokov sa používalo niekoľko desaťročí spolu s kyslíkom na spánok, ale začali sa pozorovať nežiaduce vedľajšie účinky predstavované ako „cyklopropánový šok“.
Spolu s nákladmi na náklady a vysokú horľavosti to prešlo procesom vyradenia a výmeny inými bezpečnostnými anestetickými agentmi.
Aj keď to bolo naďalej súčasťou zlúčenín používaných pri indukcii anestézie, dnes nie je súčasťou agentov používaných v lekárskych aplikáciách.
Riziká
- Cyklopropán je vysoko horľavý plyn, ktorý vytvára toxické plyny pri príchode do kontaktu s plameňom. Okrem toho môže reagovať s oxidačnými činidlami, ako sú peroxidy, peroxidy, permanganáty, dusičnany a halogény, čo spôsobuje požiare a/alebo výbuchy.
Môže vám slúžiť: kyselina chlorogenová- Cyklistika na vysokých úrovniach môže spôsobiť bolesti hlavy, závraty, nevoľnosť, strata koordinácie, pocit mdloby a/alebo vyblednutia.
- Môže tiež vytvárať nezrovnalosti v srdcovej frekvencii alebo arytmii, dýchacích ťažkostiach, kóme a dokonca aj smrti.
- Skvapalnené cyklopropy môže spôsobiť zmrazenie pokožky v dôsledku jej teploty podstatne nižšej ako nula.
- Ako plyn v podmienkach prostredia, táto zlúčenina môže ľahko vstúpiť do tela vzduchom a tiež znižuje hladinu kyslíka vo vzduchu.