Typy ketónov, vlastnosti, nomenklatúra, použitia, príklady
- 2249
- 479
- Tomáš Mydlo
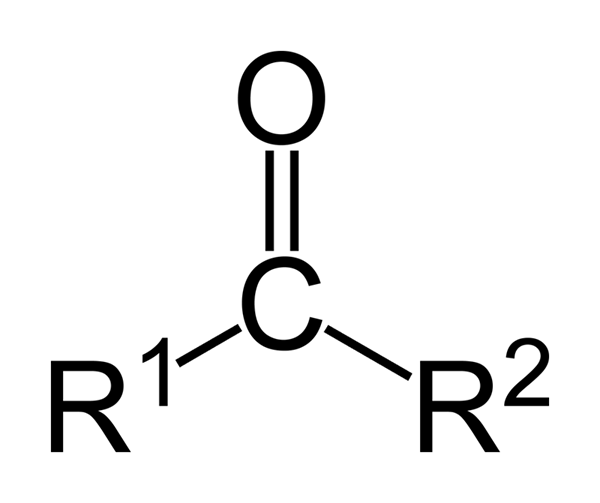
Ten ketóny Sú to organické zlúčeniny, ktoré majú karbonyl (-Co) skupinu. Sú to jednoduché zlúčeniny, v ktorých je karbona karbonylovej skupiny spojená s dvoma atómami uhlíka (a ich substituentnými reťazcami)))). Ketóny sú „jednoduché“, pretože nemajú reaktívne skupiny ako -oh alebo -cl United s uhlíkom.
Ketóny, ktoré sú uznané ako polárne zlúčeniny, sú zvyčajne rozpustné a prchavé, čo z nich robí dobré rozpúšťadlá a prísady pre parfumy. Okrem toho sa dajú ľahko pripraviť, relatívne stabilné a majú vysokú reaktivitu, vďaka čomu z nich urobila takmer dokonalú strednú zlúčeninu na prípravu zložitejších organických zlúčenín.
 Všeobecný vzorec ketónov
Všeobecný vzorec ketónov Nakoniec je eliminácia ketónov z ľudského tela zvyčajne spojená s nízkou hladinou cukru (v diabetických a/alebo extrémnych prípadoch nalačno), ktoré môžu pacientovi spôsobiť vážne zdravotné problémy.
[TOC]
Všeobecný vzorec ketónov
Ketóny sú karbonylové zlúčeniny, v ktorých je táto skupina spojená s dvoma skupinami uhľovodíkov; Môžu to byť alkylové skupiny, skupiny benzénových krúžkov alebo oboje.
Ketón môže byť reprezentovaný jednoducho ako r- (c = o) -r ', kde r a r' sú dva reťazce akéhokoľvek uhľovodíka (Alko, alkény, alkíny, cykloalcanos, deriváty benzénu a ďalšie). Na karbonylovú skupinu nie sú pripojené žiadne ketóny s vodíkom.
V priemyselnej a laboratórnej oblasti existuje široká škála metód na prípravu ketónov; Okrem toho je dôležité poznamenať, že ketóny môžu byť syntetizované rôznymi organizmami vrátane ľudských bytostí.
V priemysle najbežnejšia metóda syntézy ketónov zahŕňa oxidáciu uhľovodíkov, zvyčajne s použitím vzduchu. V malom rozsahu sa ketóny zvyčajne pripravujú oxidáciou sekundárnych alkoholov, čo poskytuje výrobky z ceny a vodou ako výrobky.
Okrem týchto najbežnejších metód je možné ketóny syntetizovať prostredníctvom alkénov, alkínov, soli zlúčenín dusíka, esterov a mnohých ďalších zlúčenín, vďaka ktorým sa ľahko získavajú.
Typy ketónov
Existuje niekoľko klasifikácií pre ketóny, v závislosti hlavne od substituentov v ich reťazcoch R. Najbežnejšie klasifikácie týchto látok sú vymenované nižšie:
Podľa štruktúry jeho reťazca
V tomto prípade je ketón klasifikovaný spôsobom, akým je jeho reťazec štruktúrovaný: alifatické ketóny sú tie, ktoré majú dva radikály R a R, ktoré majú alkyl radikálny tvar (alkány, alkény, alkíny a cykloalcanos).
Môže vám slúžiť: izoamylalkohol: štruktúra, vlastnosti, použitia a rizikáNa druhej strane, aromatické sú tie, ktoré tvoria deriváty benzénu, zatiaľ čo sú stále ketóny. Nakoniec, zmiešané ketóny sú tie, ktoré majú alquilickú a radikálnu r 'aril alebo naopak.
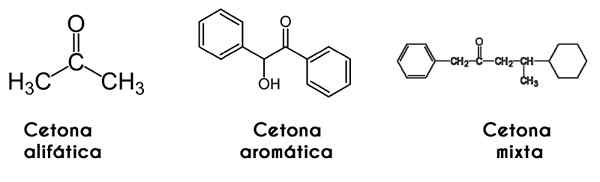 Zľava doprava: Propanona, Benzofrona a fenylmetilbutanón. Obrázky Wikimedia Commons.
Zľava doprava: Propanona, Benzofrona a fenylmetilbutanón. Obrázky Wikimedia Commons. Podľa symetrie ich radikálov
V tomto prípade sú radikály R a R študované skupinou karbonylovej skupiny; Ak sú rovnaké (rovnaké), ketón sa nazýva symetrický; Ale keď sú odlišné (ako väčšina ketónov), nazýva sa asymetrický.
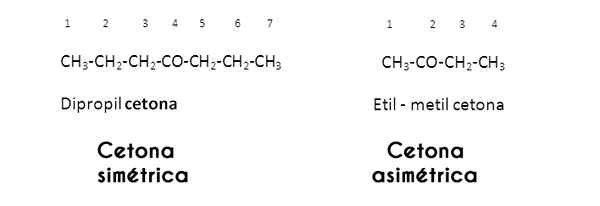 Obrázky cez Wikimedia Commons.
Obrázky cez Wikimedia Commons. Podľa saturácie jeho radikálov
Ketóny sa dajú klasifikovať aj podľa saturácie svojich uhlíkových reťazcov; Ak sú vo forme alkánov, ketón sa nazýva nasýtený ketón. Na druhej strane, ak sú reťaze ako alkény alebo alkíny, ketón sa nazýva nenasýtený ketón.
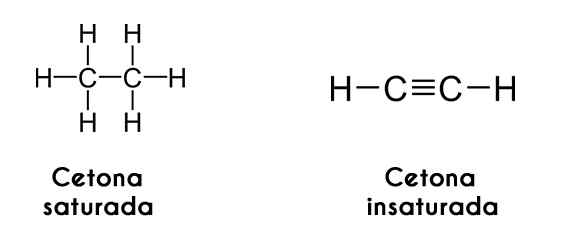 Vľavo, acetylén doprava. Obrázky cez Wikimedia Commons.
Vľavo, acetylén doprava. Obrázky cez Wikimedia Commons. Dicetóny
Toto je trieda okrem Cetony, pretože reťazce tohto ketónu majú vo svojej štruktúre dve karbonylové skupiny. Niektoré z týchto ketónov majú jedinečné vlastnosti, napríklad väčšiu dĺžku spojenia medzi uhlíkmi.
Napríklad dicetóny odvodené od cyklohexulu sú známe ako Quinonas, ktoré sú iba dva: orto-benzochinón a benzozinón.
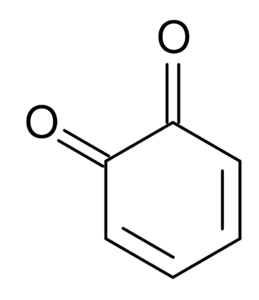 orto-benzochinón. Juh v anglickej Wikipédii / verejnej doméne
orto-benzochinón. Juh v anglickej Wikipédii / verejnej doméne Fyzikálne a chemické vlastnosti ketónov
Ketóny, rovnako ako väčšina aldehydos, sú tekuté molekuly a majú sériu fyzikálnych a chemických vlastností, ktoré sa líšia v závislosti od dĺžky ich reťazcov. Jeho vlastnosti sú opísané nižšie:
Bod varu
Ketóny sú vysoko prchavé, značne polárne a nemôžu darovať vodíkové väzby (nemajú atómy vodíka priviazané k svojej karbonylovej skupine), takže majú vyššie body varu ako alkény a étery, ale nižšie ako alkoholy rovnakej molekulárnej hmotnosti.
Bod varu ketónu sa zvyšuje so zvyšovaním veľkosti molekuly. Je to kvôli zásahu van der Waals a sily dipbola-dipolo, ktoré si vyžadujú väčšie množstvo energie na oddelenie priťahovaných atómov a elektrónov v molekule.
Rozpustnosť
Rozpustnosť ketónov má silný vplyv v časti kapacity týchto molekúl akceptovať hydrogény v ich atóme kyslíka, a tak tvoria vodíkovú väzbu s vodou. Okrem toho sily príťažlivosti, disperzie a dipólu-dipól medzi ketónmi a vodou, ktoré zvyšujú ich rozpustný účinok, sú sily.
Môže vám slúžiť: železo (prvok): Charakteristiky, chemická štruktúra, použitieKetóny strácajú kapacitu rozpustnosti, čím väčšia je ich molekula, pretože začnú vyžadovať viac energie, aby sa rozpustilo vo vode. Sú tiež rozpustné v organických zlúčeninách.
Kyslosť
Vďaka svojej karbonylovej skupine majú ketóny kyslú povahu; To sa deje v dôsledku stabilizačnej kapacity rezonancie, ktorú má táto funkčná skupina, ktorá môže poskytnúť protóny jeho dvojitej väzby na vytvorenie konjugovanej bázy nazývanej enol.
Reaktivita
Ketóny sú súčasťou veľkého počtu organických reakcií; K tomu dochádza v dôsledku náchylnosti jeho karbonylu uhlíka smerom k nukleofilnému pridávaniu, okrem polarity tohto.
Ako je uvedené vyššie, veľká reaktivita ketónov je vyrobená uznávaným medziproduktom, ktorý slúži ako základ pre syntézu iných zlúčenín.
Menovanie
Ketóny sú pomenované podľa priority alebo dôležitosti karbonylovej skupiny v celej molekule, takže keď máte molekulu riadenú karbonylovou skupinou, ketón je pomenovaný pridaním prípony „-ona“ do mena uhľovodíkového uhľovodíka.
Berie to ako hlavný reťazec väčšiu dĺžku, ktorú má karbonylová skupina, a potom je molekula pomenovaná. Ak karbonylová skupina nemá prioritu pred ostatnými funkčnými skupinami molekuly, potom je identifikovaná s „-oxo“.
V prípade komplikovanejších ketónov je možné pozíciu funkčnej skupiny identifikovať s číslom a v prípade dicetónov (ketóny s dvoma substituentmi r a r 'identické) je molekula pomenovaná s príponou „-diona“.
Nakoniec sa dá použiť slovo „Cetona“ aj po identifikácii radikálnych reťazcov spojených s karbonylovou funkčnou skupinou.
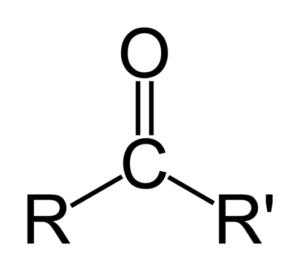
Rozdiel medzi aldehydosmi a ketónmi
Najväčší rozdiel medzi aldehydmi a ketónmi je prítomnosť atómu vodíka pripojeného k karbonylovej skupine v aldehydoch.
Tento atóm má dôležitý účinok, pokiaľ ide o zapojenie molekuly v oxidačnej reakcii: aldehyd bude tvoriť karboxylovú kyselinu alebo soľ karboxylovej kyseliny, v závislosti od toho, či k oxidácii dochádza za kyslých alebo základných podmienok za kyslých alebo základných podmienok.
Na druhej strane, Cetona tento vodík nemá, takže k minimálnym krokom potrebným na oxidáciu nedochádza.
Existujú metódy na oxidáciu ketónu (s oxidačnými činidlami oveľa silnejšími ako tie, ktoré sa zvyčajne používajú), ale rozbijú molekulu cetónu a rozdeľujú ho najskôr na dve alebo viac častí.
Môže vám slúžiť: ionizácia vo fyzike a chémii: koncept, proces a príkladyPriemyselné a každodenné použitie
V priemysle sú ketóny pozorované v parfémoch a obrazoch, pričom sa stabilizujú a kondómové papiere, ktoré bránia degradácii iných komponentov zmesi; Majú tiež široké spektrum ako rozpúšťadlá v tých odvetviach, ktoré vyrábajú výbušniny, maľby a textil, okrem farmaceutického.
Acetón (najmenší a menší ketón) je veľmi dobre známy svet rozpúšťadla.
V prírode sa môžu ketóny javiť ako cukry, nazývané ketuse. Ketosas sú monosacharidy, ktoré obsahujú cenu molekulou. Najznámejšou ketózou je fruktóza, cukor nachádzajúci sa v ovocí a mede.
Biosyntéza mastných kyselín, ktoré sa vyskytujú v cytoplazme živočíšnych buniek, sa vyskytuje aj pôsobením ketónov. Nakoniec, ako je uvedené vyššie, môže dôjsť k zvýšeniu ketónov v krvi po pôstu alebo v diabetických prípadoch.
Príklady ketónov
Butanona (C4H8Buď)
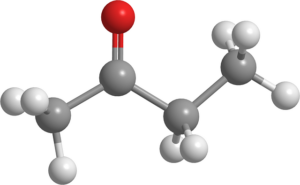 Butanón. Zdroj: Pixabay.
Butanón. Zdroj: Pixabay. Táto tekutina sa tiež nazýva MEK (alebo MEC), v priemysle sa vyrába vo veľkom rozsahu a používa sa ako rozpúšťadlo.
Cyklohexanón (c6H10Buď)
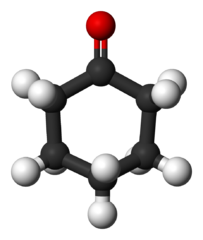 Molekula cyklohexanónu. Benjah-Bmm27 / verejná doména
Molekula cyklohexanónu. Benjah-Bmm27 / verejná doména Tento ketón sa vyrába v obrovskom meradle a používa sa ako predchodca nylonového syntetického materiálu.
Testosterón (c19H22Ani2)
 Molekula testosterónu. Wikimedia Commons
Molekula testosterónu. Wikimedia Commons Je to hlavný hormón mužského pohlavia a anabolický steroid, ktorý sa nachádza u väčšiny stavovcov.
Progesterón (cdvadsaťjedenH30Ani2)
 Medroxiprogesterón octat, zložka cyklofemínu
Medroxiprogesterón octat, zložka cyklofemínu Endogénny steroid a sexuálny hormón zapojený do menštruačného cyklu, tehotenstva a embryogenézy u ľudí a iných druhov.
Acetón (Chvály3(Co) ch3)
 Acetón. Benjah-Bmm27 / verejná doména
Acetón. Benjah-Bmm27 / verejná doména Je to tiež známa ako Propanona, je to bezfarebná zlúčenina používaná na výrobu rôznych priemyselných výrobkov, ako sú plasty, ako aj pre domáce hygiene a kozmetiku, ako je odstránenie.
Kortizón (cdvadsaťjedenH28Ani5)
 Kortizón. Benjah-Bmm27 / verejná doména
Kortizón. Benjah-Bmm27 / verejná doména Steroidný hormón používaný na boj proti určitým chorobám a stavom, ako sú zápaly, akné, alergie a iné typy kožných reakcií, astma alebo rakovina a leukémia.
Benzofenón (c13H10Buď)
 Benzofenóm. Benjah-Bmm27 / verejná doména
Benzofenóm. Benjah-Bmm27 / verejná doména Zlúčenina široko používaná pri vytváraní parfumov a iných produktov kozmetiky alebo ochrany pred slnkom kvôli jeho aromatickému zloženiu.
Odkazy
- Wikipedia. (s.F.). Ketón. Získané z in.Wikipedia.orgán
- Britannica, e. (s.F.). Ketón. Získané od Britannica.com
- Univerzita, m. Siež. (s.F.). Aldehydy a ketóny. Získané z chémie.MSU.Edu
- Chemguide. (s.F.). Úvod aldehydy a ketóny. Získané z chemguide.co.Uk
- Calgary, u. Ani. (s.F.). Ketóny. Získané od Chem.Ucalgary.Ac

