Časti galvanických buniek, ako funguje, aplikácie, príklady

- 1528
- 307
- MUDr. Miloslav Habšuda
Ten Galvanická bunka O voltaická bunka je typ elektrochemickej bunky, ktorá pozostáva z dvoch rôznych kovov ponorených do dvoch semi -lladov, v ktorých je zlúčenina v aktívnom roztoku spontánna reakcia.
Potom je jeden z kovov v jednom zo semilladov oxidovaný, zatiaľ čo kov ostatných semi -demedia sa zníži a vytvára výmenu elektrónov cez vonkajší obvod. To umožňuje využívať elektrický prúd.
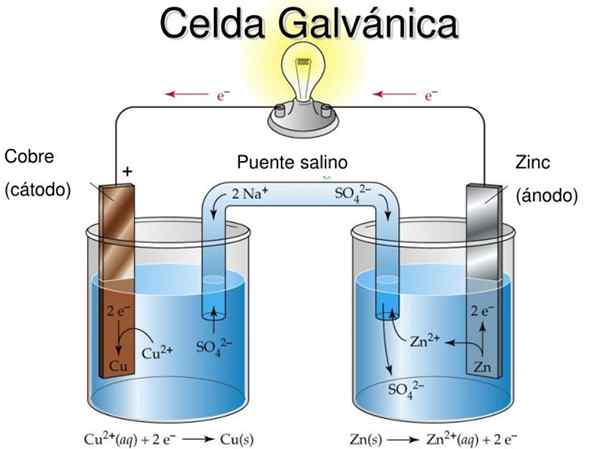
 postava 1. Schéma a časti galvanickej bunky. Zdroj: Korint.Pucp.Edu.pešo.
postava 1. Schéma a časti galvanickej bunky. Zdroj: Korint.Pucp.Edu.pešo. Názov „Galvanic Cell“ je na počesť jedného z priekopníkov experimentovania s elektrinou: taliansky lekár a fyziológ Luigi Galvani (1737-1798).
Galvani v roku 1780 zistil, že ak sa pripojili k jedným koncovým káblom rôznych kovov a voľné konce boli do kontaktu s ANCA žaby (mŕtve), došlo k kontrakcii.
Prvým, ktorý vybudoval elektrochémiu bunky na výrobu elektriny, bola tiež talianska Alessandro Volta (1745-1827) v roku 1800, a teda alternatívny názov voltaických buniek.
Časti galvanickej bunky
Časti galvanickej bunky sú znázornené na obrázku 1 a sú nasledujúce:
1.- Anodické semiflexie
2.- Anodická elektróda
3.- Anodický roztok
4.- Katódová semifinácia
5.- Katódová elektróda
6.- Katódový roztok
7.- Soľný most
8.- Kovár
9.- Voltmeter
Fungujúci
Aby sme vysvetlili fungovanie galvanickej bunky, budeme sa spoliehať na dolnú:
 Obrázok 2. Galvanický didaktický model. Zdroj: Presúva sa.com
Obrázok 2. Galvanický didaktický model. Zdroj: Presúva sa.com Základnou myšlienkou galvanickej bunky spočíva v tom, že kov, ktorý trpel oxidačnou reakciou, je fyzicky oddelený od zníženého kovu, takže výmena elektrónov sa vyskytuje prostredníctvom vonkajšieho vodiča, ktorý umožňuje využívať výhody prietoku elektrického prúdu , Napríklad na zapálenie žiarovky alebo LED.
Na obrázku 2 v polotydia vľavo máte kovovú medenú pásku (Cu) ponorenú do roztoku sulfátu medi (CUS04), Zatiaľ čo v pravom semi -lid je v roztoku síranu sulfátu zinku (Zink) ponorený do roztoku sulfátu zinku (Znso4).
Malo by sa poznamenať, že v každom semi -mdele je kov každého z nich prítomný v dvoch oxidačných stavoch: neutrálne kovové atómy a kovové ióny soli toho istého kovu v roztoku.
Ak kovové pásky nie sú spojené vonkajším vodivým káblom, potom oba kovy oxidujú osobitne vo svojich bunkách.
Ak je však elektricky spojená, v Zn sa vyskytne oxidácia, zatiaľ čo v Cu dôjde k redukčnej reakcii. Je to preto, že stupeň oxidácie zinku je väčší ako stupeň meďnatiny.
Kov, ktorý oxiduje, poskytuje kov, ktorý je redukovaný vonkajším vodičom, a tento prúd sa môže použiť.
Môže vám slúžiť: halogénované derivátyOxidácia a redukčné reakcie
Reakcia, ktorá sa vyskytuje na pravej strane medzi kovovou elektródou zinku a vodným roztokom síranu zinočnatého, je nasledujúca:
Znani(S) + Zn2+ (SW4)2- → 2 Zn2+(Ac) + (SW4)2- + 2 e-
Atóm zinku (tuhý) na povrchu anodickej elektródy v semifinále vpravo, stimulovaný pozitívnymi iónmi zinku v roztoku, poskytuje dva elektróny a vynára sa z elektródy, chodí do vodného roztoku ako pozitívny dvojitý ión zinku.
Uvedomili sme si, že čistým výsledkom bolo, že atóm neutrálneho kovového zinku, stratou dvoch elektrónov, sa stal iónom zinku, ktorý prispieva k vodnému roztoku, takže zinková tyčinka stratila atóm a roztok získal pozitívny dvojitý ión.
Oslobodené elektróny sa uprednostňujú, aby sa pohybovali vonkajším káblom smerom k kovu ostatných semidedov s kladným zaťažením (Cartodo +). Zinkový bar stráca hmotnosť, pretože jej atómy postupne prechádzajú do vodného roztoku.
Oxidáciu zinku možno zhrnúť takto:
Znani(S) → Zn2+(Ac) + 2 e-
Reakcia, ktorá sa vyskytuje na ľavej strane, je podobná, ale meď vodného roztoku zachytáva dva elektróny (pochádzajúce z ostatných semimeded) a ukladá sa do medenej elektródy. Keď atóm zachytí elektróny, hovorí sa, že je znížený.
Reakcia redukcie meďnatiny je napísaná takto:
Cu2+(Ac) + 2 e- → Cuani(S)
Medená lišta získava cesto, pretože ióny roztoku prechádzajú do baru.
Oxidácia sa vyskytuje v anóde (negatívna), ktorá odpudzuje elektróny, zatiaľ čo k redukcii dochádza v katóde (pozitívna), ktorá priťahuje elektróny. Elektrónová výmena sa vyskytuje prostredníctvom externého ovládača.
Soľný most
Soľný most vyvažuje zaťaženie, ktoré sa hromadia v oboch polotovaroch. V anodických semi -de -kladných iónoch sa hromadí, zatiaľ čo v katóde existuje prebytok negatívnych sulfátových iónov.
Na soľný mostík sa používa roztok soli (ako je chlorid sodný alebo chlorid draselného), ktorý nezasahuje do reakcie, ktorá je v invertovanej trubici v tvare U s jej koncami zapojenými stenou porézneho materiálu.
Jediným účelom soľného mosta je filtrovanie iónov do každého vyváženia alebo neutralizácie nadbytočného zaťaženia bunky. Cez soľný mostík je teda prúdom prúdu cez soľné ióny, ktorý uzatvára elektrický obvod.
Oxidácia a redukčný potenciál
Pochopia sa štandardné oxidačné a redukčné potenciály.
Môže vám slúžiť: Scandio: História, vlastnosti, reakcie, riziká a použitiaPre zinok je jeho štandardný oxidačný potenciálvôl = +0,76 V. Medzitým je štandardný potenciál redukcie pre meď amriežka = +0,34 V. Elektromotívna sila (FEM) produkovaná touto galvanickou bunkou je: FEM = +0,76 V + 0,34 V = 1,1 V.
Globálnu reakciu galvanickej bunky možno napísať takto:
Znani(S) + Cu2+(Ac) → Zn2+(Ac) + Cuani(S)
Berúc do úvahy sulfát, čistá reakcia je:
Znani(S) + Cu2+ (SW4)2- 25 ° C → Zn2+ (SW4)2-+ Cuani(S)
Síran je divák, zatiaľ čo kovy vymieňajú elektróny.
Symbolické znázornenie galvanickej bunky
Galvanická bunka na obrázku 2 je symbolicky znázornená nasledovne:
Znani(S)| Zn2+(Ac) (1 m) || Cu2+(Ac) (1 m) | cuani(S)
Konvenciou vľavo kov, ktorý oxiduje a tvorí anódu (-) a oddelený tyčou (|), je vždy umiestnený ión vo vodnom stave. Anodické semi -Medium je oddelené od katódy dvoma pruhmi (||), ktoré predstavuje soľný most. Vpravo, kovové polotymédium, ktoré je redukované a tvorí sa katóda (+) umiestni.
V symbolickej reprezentácii galvanickej bunky je koniec vždy kov, ktorý oxiduje a na konci sa kov umiestni (v tuhom stave), ktorý je redukovaný. Malo by sa poznamenať, že na obrázku 2 sú sériy v opačnom prípade, pokiaľ ide o konvenčné symbolické znázornenie.
Žiadosti
Známy štandardný oxidačný potenciál rôznych kovov je možné určiť elektromotívnu silu, ktorá bude produkovať galvanickú hromadu postavenú z týchto kovov.
V tejto časti sa vyššie uvedené uplatňuje v predchádzajúcich častiach na výpočet čistej elektromotorickej sily bunky postavenej z iných kovov.
Ako príklad aplikácie uvažujeme o galvanickej železnej bunke (viera) a meď (Cu). Ako údaje sú uvedené nasledujúce redukčné reakcie a jeho štandardný redukčný potenciál, to znamená pri koncentrácii 25 ° C a 1M:
Vernosť2+(Ac) + 2 e- → Viera(S). E1mriežka = -0,44 V
Cu2+(Ac) + 2 e- → Cu(S). E2mriežka = +0,34 V
Žiada sa, aby našla čistú elektromotorickú silu produkovanú nasledujúcou galvanickou bunkou:
Vernosť(S)| Viera2+(Ac)(1 m) || cu2+(Ac)| Cu(S)
V tejto hromade železo oxiduje a je anódou galvanickej bunky, zatiaľ čo meď sa redukuje a je katóda. Potenciál oxidácie železa je rovnaký, ale na rozdiel od jeho redukčného potenciálu, to znamená E1Oxd = +0,44.
Aby sme získali elektromotívnu silu produkovanú touto galvanickou bunkou, pridáme potenciál oxidácie železa s potenciálom redukcie meďnatého:
Môže vám slúžiť: oxidy dusíka (NOx)FEM = E1Oxd + E2mriežka = -E1mriežka + E2mriežka = 0,44 V + 0,34 V = 0,78 V.
Galvanická bunka v každodennom živote
Galvanické bunky na každodenné použitie sú ďaleko od formy používanej ako didaktický model, ale ich princíp prevádzky je rovnaký.
Najbežnejšou bunkou použitia je 1,5 V alkalickej batérie v rôznych prezentáciách. Prvé meno prichádza, pretože je to skupina buniek spojených v sérii, aby sa zvýšila FEM.
Nabíjateľné lítiové batérie sú tiež založené na rovnakom princípe prevádzky galvanických buniek a sú to používané v smartfónoch, hodinkách a iných zariadeniach.
Rovnakým spôsobom sú olovené batérie automobilov, motocyklov a lodí 12 V a sú založené na rovnakom princípe prevádzky galvanickej bunky.
Galvanické bunky sa používajú v estetike a regenerácii svalov. Existujú ošetrenia tváre, ktoré pozostávajú z aplikácie prúdu dvoma elektródami vo forme valca alebo gule, ktoré čistia a tonifikujú pokožku.
Súčasné impulzy sa vzťahujú aj na regeneráciu svalovej svaly u ľudí, ktorí sú v stave poklony.
Výstavba domácej galvanickej bunky
Existuje mnoho spôsobov, ako vybudovať domácu galvanickú bunku. Jedným z najjednoduchších je použitie octu ako roztoku, oceľových klincov a medených káblov.
Materiál
-Jednorazové plastové nádoby
-biely ocot
-Dve oceľové skrutky
-Dva kusy nahého medeného drôtu (bez izolácie alebo laku)
-Voltmeter
Postup
-Naplňte ¾ častí skla octom.
-Pripojte dve oceľové skrutky s niekoľkými zákrutami drôtu a nechajte kúsok drôtu bez navíjania.
Nekonečný koniec medeného kábla je zložený v obrátenom u -tvare.
 Obrázok 3. Domáce galvanické bunky a multimeter. Zdroj: YouTube.com
Obrázok 3. Domáce galvanické bunky a multimeter. Zdroj: YouTube.com Ďalší kúsok medeného kábla je tiež zložený do obráteného a visí na okraji skla v diametrálne opačnej polohe od ponorených skrutiek, takže jedna časť medi je vo vnútri octu a druhá časť medeného kábla na vonkajšej strane vonkajšej strany sklo.
Voľné konce voltmetrových káblov sú pripojené na meranie elektromotívnej sily produkovanej touto jednoduchou bunkou. FEM tohto typu bunky je 0,5 V. Na zladenie FEM alkalickej batérie je potrebné postaviť ďalšie dve bunky a pripojiť sa k trom v sérii, takže sa získa batéria 1,5V
Odkazy
- Borneo, r. Galvanické a elektrolytické bunky. Zdroj: triedy Quimica.Blog.com
- Cedrón, J. Všeobecná chémia. Pucp. Získané z: Korint.Pucp.Edu.pešo
- Farrera, L. Úvod do elektrochémie. Oddelenie fyzikálneho pôsobenia UNAM. Získané z: Depa.Frame.Žobrák.mx.
- Wikipedia. Elektrochemická bunka. Obnovené z: je.Wikipedia.com.
- Wikipedia. Galvanická bunka. Obnovené z: je.Wikipedia.com.

