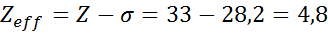Efektívne jadrové zaťaženie
- 5038
- 204
- Denis Škriniar
Čo je účinné jadrové zaťaženie?
Ten efektívne jadrové zaťaženie (Zastúpené ako zEfekt A v niektorých prípadoch ako z*) Je to čisté jadrové zaťaženie, ktoré elektrón má, keď je v polyhelektronickom atóme (to znamená, že má viac ako jeden elektrón).
Presnejšie povedané, je to elektrický náboj, ktorý by mal jadro hypotetického atómu schopného prilákať jeho jediný elektrón s rovnakou silou, s ktorou jadro skutočného atómu priťahuje ten istý elektrón v prítomnosti všetkých ostatných elektrónov.
Je to korigované jadrové zaťaženie, ktoré berie do úvahy účinok prítomnosti iných elektrónov na polylektronický atóm. Toto znížené zaťaženie vysvetľuje, prečo sú najvzdialenejšie elektróny v polyhelektronickom atóme slabo spojené s jadrom ako vnútorné elektróny.
Efektívne jadrové zaťaženie je koncept veľkého významu v chémii, pretože nám umožňuje porozumieť periodickej tendencii mnohých vlastností, ako je atómový polomer, polomer iónov, elektronegativita, ionizačné energie a ďalšie.
Prečo existuje efektívne jadrové zaťaženie?
Efektívne jadrové zaťaženie vyplýva z dvoch javov:
- Tieniaci účinok elektrónov na polyhelektronické atómy.
- Elektrostatické odpudenie medzi elektrónmi, pretože každý má rovnaký elektrický náboj.
On účinok na tienenie Pozostáva z druhu štítu tvoreného vnútornými elektrónmi atómu, ktorý pokrýva jadro. Vďaka tomu je najvzdialenejšie elektróny „cítiť“ nižšiu príťažlivosť zo strany jadra, ako by sa cítili, keby ostatné elektróny neboli prítomné.
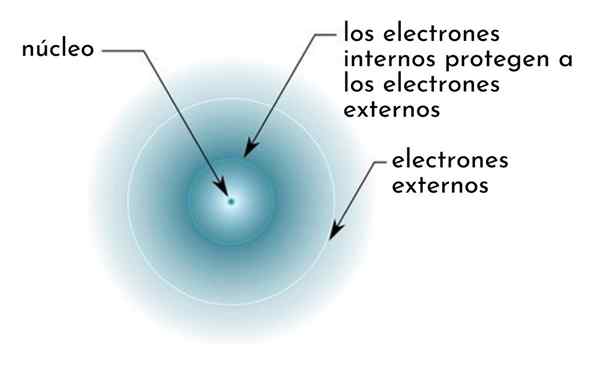 Obrázok schematicky zobrazujúci vnútorné elektróny pôsobiace ako obrazovka, ktorá chráni vonkajšie elektróny príťažlivosti jadra
Obrázok schematicky zobrazujúci vnútorné elektróny pôsobiace ako obrazovka, ktorá chráni vonkajšie elektróny príťažlivosti jadra Napríklad jadrové zaťaženie atómu sodného je +11 (jeho atómové číslo je z = 11), ale jediný elektrón Valencie, ktorý má, skutočne pociťuje silu príťažlivosti zaťaženia iba +2,2.
Môže vám slúžiť: benzoát sodný: štruktúra, vlastnosti, použitia a rizikáInými slovami, tienenie ďalších 10 vnútorných elektrónov spôsobuje, že elektrón sodíka Valencia pocítil silu jadrovej príťažlivosti iba piatej z toho, čo by malo byť.
Okrem tieniaceho efektu Odpudk medzi elektrónmi (ktoré majú rovnaký elektrický náboj) tiež prispieva k pôsobeniu kapacity jadra na prilákanie vonkajších elektrónov. To znamená, že toto odporovanie tiež pomáha znižovať účinné jadrové zaťaženie.
Dôležité charakteristiky účinného jadrového zaťaženia
Je potrebné poznamenať, že tieniaci účinok zodpovedný za zníženie efektívneho jadrového zaťaženia ovplyvňuje iba elektróny, ktoré sú na rovnakej úrovni energie alebo v horných vrstvách, ale nie najviac vnútorných elektrónov. Okrem toho účinok nie je rovnaký pre elektróny nájdené na atómových orbitáloch S a P ako na orbitáloch D a F.
Z tohto dôvodu sa každá elektrónová sada každej vrstvy alebo energetickej úrovne cíti inak efektívne jadrové zaťaženie. To má dôležité dôsledky týkajúce sa chemických vlastností rôznych prvkov.
Pravidelný trend efektívneho jadrového zaťaženia
Za obdobie
Elektróny umiestnené na rovnakej úrovni energie sú menej tienené ako elektróny, ktoré sa nachádzajú v nižších úrovniach energie.
Z tohto. Z tohto dôvodu efektívne jadrové zaťaženie v periodickej tabuľke sa zvyšuje zľava doprava.
V celej skupine
Na druhej strane, keď prechádzame z jedného obdobia do druhej v tej istej skupine (to znamená, keď sa pohybujeme nadol po skupine), pridajú sa celé vrstvy veľmi tieniacich vnútorných elektrónov. Vďaka tomu sa efektívne jadrové zaťaženie znižuje zhora nadol alebo čo je rovnaké, Zvýšenie zdola nahor.
Môže vám slúžiť: ayaroínaEfektívny vzorec jadrového zaťaženia
Efektívne jadrové zaťaženie je možné vypočítať pomocou veľmi jednoduchej polo -časovej rovnice, ktorá zohľadňuje skutočnú hodnotu jadrového zaťaženia (daná atómovým číslom, Z) a termínom nazývaným konštantné tienenie. Ten zahŕňa účinky prítomnosti iných elektrónov v jednom.
Rovnica je daná:
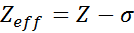
kde z je atómové číslo a σ (grécke písmeno sigma) predstavuje tieniacu konštantu, ktorá závisí od elektronickej konfigurácie.
Slater
Shielding Constant možno odhadnúť zo systému známeho ako pravidlá Slater. Tieto pravidlá umožňujú výpočet konštanty štítu elektrónu pridaním príspevkov ostatných elektrónov k uvedenej konštante tienenia. Tieto pravidlá možno zhrnúť takto:
- Akýkoľvek elektrón, ktorý je na rovnakej úrovni energie (úroveň n0) Poskytuje množstvo 0,35 pre tieniacu konštantu, pokiaľ nie sú na úrovni 1, v takom prípade poskytuje 0,30.
- Každý elektrón, ktorý je na predchádzajúcej predchádzajúcej úrovni (na úrovni n0-1) v orbitálnom S alebo P prináša 0,85; Na druhej strane, ak je v orbitálnom d alebo f, prispieva 1.
- Všetky ostatné elektróny, ktoré sú na nižšej úrovni energie (n0-2, n0-3, atď.) prispievať 1 k tieniacej konštante.
Príklad efektívneho výpočtu jadrového zaťaženia
Valencia Elektron atómu sodného
Elektronická konfigurácia atómu sodíka je 1s22s22 P63s1. To znamená, že ak chceme vypočítať efektívne jadrové zaťaženie, ktoré cíti elektrón Valencia (elektrón 3s1), musíme pridať príspevky ostatných 10 elektrónov podľa pravidiel Slatera.
Môže vám slúžiť: oxid železa (ii): Štruktúra, nomenklatúra, vlastnosti, použitiaAko vypočítame konštantu elektrónového štítu 3S1 (n0= 3) a to je samo o sebe vo vrstve Valencia, na rovnakej úrovni energie nie sú žiadne iné elektróny.
Okamžite predchádzajúca úroveň je n0-1 = 2, kde je 8 elektrónov v orbitáli S alebo P, ktoré prispievajú 0,85, a na orbitáloch D alebo F nie sú žiadne elektróny.
Nakoniec, jediná úroveň nižšia ako 2 je n = 1, v ktorej existujú iba 2 elektróny. To všetko je zhrnuté v nasledujúcej tabuľke:
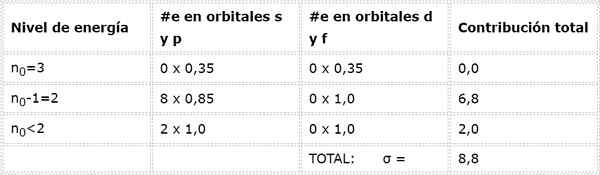
Ako je zrejmé, vnútorné elektróny sodíka poskytujú štít konštantu 8,8, takže účinné jadrové zaťaženie, ktoré elektrón cíti 3s1 je:
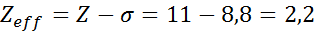
Elektróny arzénu Valencia
Elektronická konfigurácia arzénu je 1s22s22 P63s23p63D104s24p3. Vrstva Valencia je vrstva 4 (n0= 4), ktorý má 5 elektrónov: (4s24p3). V tomto prípade bude každý z týchto 5 elektrónov pocítiť účinok ostatných 4, ktoré sú v rovnakej vrstve a účinku ďalších 28 vnútorných elektrónov, ako je uvedené v tabuľke:
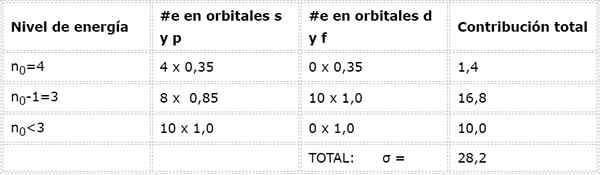
Preto účinné jadrové zaťaženie, ktoré pociťuje elektróny arzénu Valencia, je: